题目内容
2.铝是地壳中含量最高的金属元素,其单质、合金及其化合物在生产生活中的应用日趋广泛,铝土矿是生产铝及其化合物的重要原料.(1)铝元素在元素周期表中的位置是第三周期第ⅢA族.
(2)铝电池性能优越,铝一空气电池以其环保、安全而受到越来越多的关注,其原理如图所示.
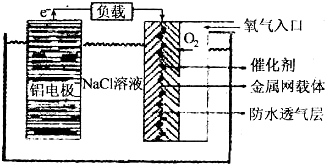
①该电池的总反应化学方程式为4Al+3O2+6H2O=4Al(OH)3;
②电池中NaCl的作用是增强溶液的导电能力.
③以铝一空气电池为电源电解KI溶液制取KIO3(石墨为电极材料)时,电解过程中阳极的电极反应式为I-+3H2O-6e-=IO3-+6H+.
④某铝一空气电池的效率为50%,若用其作电源电解500mL的饱和NaCl溶液,电解结束后,所得溶液(假设溶液电解前后体积不变)中NaOH的浓度为0.3mol•L-1,则该过程中消耗铝的质量为2.7g.
(3)氯化铝广泛用于有机合成和石油工业的催化剂,聚氯化铝也被用于城市污水处理.
①氯化铝在加热条件下易升华,气态氯化铝的化学式为Al2Cl6,每种元素的原子最外层均达到8电子稳定结构,则其结构式为
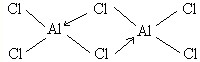 .
.②将铝土矿粉与碳粉混合后加热并通入氯气,可得到氯化铝,同时生成CO,写出该反应的化学方程式Al2O3+3C+3Cl2$\frac{\underline{\;\;△\;\;}}{\;}$2AlCl3+3CO.
分析 (1)根据铝的电子层数和最外层电子数确定其在周期表中的位置;
(2)①铝和氧气、水能反应生成氢氧化铝;
②溶液中自由移动的离子浓度越大,溶液的导电性越强;
③阳极上失电子发生氧化反应;
④先根据氢氧化钠的物质的量计算电解时转移电子的物质的量,再根据原电池中电池的效率计算原电池中转移电子的物质的量,最后根据转移电子的物质的量计算消耗的铝的质量;
(3)①根据氯化铝的结构特点结合题意写出结构式;
②根据反应物、生成物和反应条件写出反应方程式.
解答 解:(1)铝原子原子核外有3个电子层,最外层上有3个电子,所以其在周期表中的位置是第三周期第ⅢA族,故答案为:第三周期第ⅢA族;
(2)①铝和氧气、水能反应生成氢氧化铝,反应方程式为:4Al+3O2+6H2O=4Al(OH)3,故答案为:4Al+3O2+6H2O=4Al(OH)3;
②溶液中自由移动的离子浓度越大,溶液的导电性越强,水是弱电解质导电能力较小,为增大水的导电性,所以加入氯化钠,故答案为:增强溶液的导电能力;
③阳极上失电子发生氧化反应,所以电解碘化钾溶液时,阳极上碘离子放电和水反应生成碘酸根离子和氢离子,电极反应式为:I-+3H2O-6e-=IO3-+6H+,
故答案为:I-+3H2O-6e-=IO3-+6H+;
④电解氯化钠溶液后,氢氧化钠的物质的量=0.3mol/L×0.5L=0.15mol,设电解过程中电子转移的物质的量是x,
2NaCl+2H2O$\frac{\underline{\;电解\;}}{\;}$2NaOH+Cl2↑+H2↑ 转移电子
2mol 2mol
0.15mol x
x=0.15mol
某铝一空气电池的效率为50%,所以原电池中转移电子的物质的量是0.3mol,设消耗铝的质量为y.
Al-3e-=Al3+
27g 3mol
y 0.3mol
y=2.7g
故答案为:2.7g;
(3)①氯化铝为共价化合物,氯原子提供孤对对子,铝原子提供空轨道,形成配位键,使所有原子均达到8电子稳定结构,所以结构式为 ,故答案为:
,故答案为: ;
;
②根据题意知,反应物是氧化铝、碳和氯气,反应条件是加热,生成物是氯化铝和一氧化碳,所以其反应方程式为:Al2O3+3C+3Cl2$\frac{\underline{\;\;△\;\;}}{\;}$2AlCl3+3CO,
故答案为:Al2O3+3C+3Cl2$\frac{\underline{\;\;△\;\;}}{\;}$2AlCl3+3CO.
点评 本题考查了结构式、电极反应式、化学反应方程式的书写、物质的量的有关计算等知识点,注意氯化铝结构式的书写,为易错点,该结构式中存在配位键导致容易写错.

 学练快车道快乐假期寒假作业系列答案
学练快车道快乐假期寒假作业系列答案| A. |  定容 | B. |  稀释浓硫酸 | C. |  排水法收集NO | D. |  实验室制氨气 |
| A. | CH3+ | B. | CH3- | C. | SO42- | D. | NO3- |
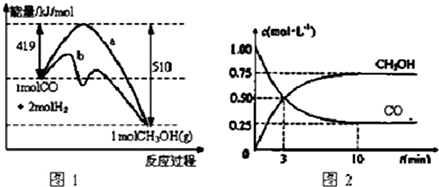
| A. | v(A)=0.5mol•L-1•s-1 | B. | v(B)=0.3mol•L-1•s-1 | ||
| C. | v(C)=0.8mol•L-1•s-1 | D. | v( D )=1.0mol•L-1•s-1 |
溶解度/(g/100g水)
| 温度0C化合物 | 0 | 20 | 40 | 60 | 80 | 100 |
| NH4Cl | 29.3 | 37.2 | 45.8 | 55.3 | 65.6 | 77.3 |
| ZnCl2 | 343 | 395 | 452 | 488 | 541 | 614 |
| 化合物 | Zn(OH)2 | Fe(OH)2 | Fe(OH)3 |
| Ksp近似值 | 10-17 | 10-17 | 10-39 |
(1)该电池的正极反应式为MnO2+H++e-=MnOOH,电池反应的离子方程式为2MnO2+Zn+2H+=2MnOOH+Zn2+
(2)每转移0.04mol电子,理论消耗Zn1.3g.(Zn的摩尔质量=65g/mol)
(3)废电池糊状填充物加水处理后,过滤,滤液中主要有氯化锌和氯化铵,两者可以通过加热浓缩、冷却结晶分离回收,滤渣的主要成分是二氧化锰、碳粉和MnOOH,欲从中得到较纯的二氧化锰,最简便的方法是空气中加热,其原理是碳粉转变为二氧化碳,MnOOH氧化为二氧化锰.
(4)用废电池的锌皮制作七水合硫酸锌,需去除少量杂质铁,其方法是:加入稀硫酸和双氧水,溶解,铁变为Fe3+,加碱调节PH为2.7,铁刚好完全沉淀(离子浓度小于1×10-5mol/L时,即可认为该离子沉淀完全).继续加碱调节PH为6,锌开始沉淀(假定Zn2+浓度为0.1mol/L).若上述过程不加双氧水的后果是Zn2+和Fe2+分离不开,原因是Zn(OH)2、Fe(OH)2的Ksp相近.
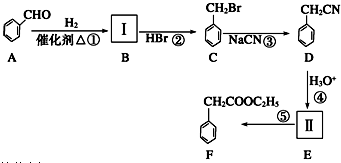
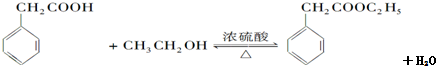 (要求写出反应条件).
(要求写出反应条件). (要求写出反应条件).
(要求写出反应条件). .
.