题目内容
15.下列说法不正确的是( )| A. | 要想使AlCl3溶液中的Al3+几乎全部沉淀出来,可以加入过量的氨水 | |
| B. | 向FeCl2溶液中加入氨水,最终会看到红褐色沉淀 | |
| C. | 漂白粉的有效成分是次氯酸钙 | |
| D. | 氢氧化钠、纯碱溶液要存放在带磨砂玻璃塞的试剂瓶中 |
分析 A、根据题意,Al3+转化为不溶于水的物质是Al(OH)3,Al(OH)3具有两性,既能和强酸反应又能和强碱反应,要使AlCl3溶液中的Al3+完全沉淀,选取试剂时就不能选强碱,只能是弱碱;
B、氯化亚铁和一水合氨反应生成氢氧化亚铁,氢氧化亚铁不稳定,易被氧化得到红褐色沉淀氢氧化铁;
C、漂白粉具有漂白性的原因是:Ca(ClO)2+CO2+H2O=CaCO3+2HClO,HClO具有漂白性,有效成分是次氯酸钙;
D、NaOH、碳酸钠溶液都呈碱性,碱和二氧化硅反应生成粘性物质硅酸钠.
解答 解:A、氨水是弱碱,加入过量的氨水能把铝离子完全沉淀,故A正确;
B、氯化亚铁和一水合氨反应生成氢氧化亚铁,氢氧化亚铁不稳定,易被氧化得到红褐色沉淀氢氧化铁,Fe2++2NH3.H2O=Fe(OH)2↓+2NH4+、4Fe(OH)2+O2+2H2O=4Fe(OH)3,故B正确;
C、漂白粉具有漂白性的原因是:Ca(ClO)2+CO2+H2O=CaCO3+2HClO,HClO具有漂白性,则有效成分为Ca(ClO)2,主要成分为CaCl2和Ca(ClO)2,漂白粉的有效成分是次氯酸钙,故C正确;
D、NaOH、碳酸钠溶液都呈碱性,碱和二氧化硅反应生成粘性物质硅酸钠,从而打不开瓶塞,所以氢氧化钠、纯碱溶液要存放在带橡胶塞的试剂瓶中,故D错误;
故选D.
点评 本题考查物质的性质及试剂的存放,涉及铝、铁、钠等元素化合物,明确物质的性质是解本题关键,熟练掌握铝三角、铁三角知识,知道氢氧化铝的制备方法,题目难度不大.

练习册系列答案
 课时训练江苏人民出版社系列答案
课时训练江苏人民出版社系列答案
相关题目
5.物质的量浓度均为0.1mol•L-1的四种溶液:①NH4Cl溶液,②NH4HSO4溶液,③CH3COONH4溶液,④氨水,其c(NH4+)从大到小的顺序为( )
| A. | ②①③④ | B. | ①②③④ | C. | ④②①③ | D. | ①②④③ |
3.将一定量的锌与200mL 18.5mol•L-1浓硫酸充分反应后,锌完全溶解,同时生成气体A 33.6L(标准状况).将反应后的溶液稀释到2L,测得溶液中c(H+)=1mol•L-1,则下列叙述中错误的是( )
| A. | 反应中共转移电子3mol | |
| B. | 反应中共消耗锌97.5 g | |
| C. | 气体A中SO2和H2的体积比为4:1 | |
| D. | 稀释后的溶液中c(SO42-)=1.55 mol•L-1 |
10.设NA代表阿伏加德罗常数的数值,下列说法中正确的是( )
| A. | 常温常压下,32g氧气所含的原子数为NA | |
| B. | 标准状况下,22.4L 四氯化碳的分子数为NA | |
| C. | 0℃,101KPa下,44.8L氮气所含有的分子数为2NA | |
| D. | 常温常压下,1mol氦气含有的分子数为2NA |
20.已知:CO(g)+$\frac{1}{2}$O2(g)=CO2(g);△H=-283kJ/mol
Na2O2(s)+CO2(g)═Na2CO3(s)+$\frac{1}{2}$O2(g);△H=-226kJ/mol
根据以上热化学方程式判断,下列说法正确的是( )
Na2O2(s)+CO2(g)═Na2CO3(s)+$\frac{1}{2}$O2(g);△H=-226kJ/mol
根据以上热化学方程式判断,下列说法正确的是( )
| A. | CO的燃烧热为283kJ | |
| B. | 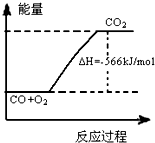 如图可表示由CO生成CO2的反应过程和能量关系 | |
| C. | Na2O2(s)+CO(g)=Na2CO3(s);△H=-509kJ/mol | |
| D. | Na2O2(s)与CO2(g)反应放出226kJ热量时,电子转移数为2NA |
4.下列有机物的命名正确的是 ( )
| A. | 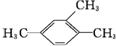 1,3,4-三甲苯 1,3,4-三甲苯 | B. | 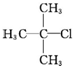 2-甲基-2-氯丙烷 2-甲基-2-氯丙烷 | C. | 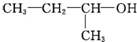 2-丁醇 2-丁醇 | D. | 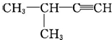 2-甲基-3-丁炔 2-甲基-3-丁炔 |