题目内容
【题目】可逆反应2SO2(g)+O2(g)![]() 2SO3(g)是硫酸工业中非常重要的一个反应,因该反应中使用催化剂而被命名为接触法制硫酸。
2SO3(g)是硫酸工业中非常重要的一个反应,因该反应中使用催化剂而被命名为接触法制硫酸。
(1)使用 V2O5 催化该反应时,涉及到催化剂 V2O5 的热化学反应有:
①V2O5 (s)+SO2 (g)![]() V2 O4 (s)+SO3 (g) △H1=+59.6kJ·mol-1
V2 O4 (s)+SO3 (g) △H1=+59.6kJ·mol-1
②2V2O4(s)+O2(g)![]() 2V2O5(s) △H2=-314.4kJ·mol-1
2V2O5(s) △H2=-314.4kJ·mol-1
则2SO2(g)+O2(g)![]() 2SO3(g) △H3=_____,若降低温度,该反应速率会_____(填“增大”或“减小”)
2SO3(g) △H3=_____,若降低温度,该反应速率会_____(填“增大”或“减小”)
(2)向 10 L 密闭容器中加入 V2O4(s)、SO2(g)各 1 mol 及一定量的 O2,改变加入 O2 的量,在常温下反应一段时间后,测得容器中 V2O4、V2O5、SO2 和 SO3 的量随反应前加入 O2 的变化如图甲所示,图中没有 生成 SO3 的可能原因是____________________________________________________。
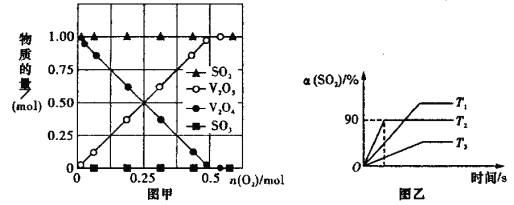
(3)向 10 L 密闭容器中加入 V2O5(s)、SO2(g)各 0.6mol,O2(g)0.3mol,保持恒压的条件下 分别在 T1、T2、T3 三种温度下进行反应,测得容器中 SO2 的转化率如图乙所示。
①T1 _____T2(填“>”或“<”)。
②T2时,2SO2(g)+O2(g)![]() 2SO3(g)的平衡常数K=_____。若向该容器通入高温 He(g)(不参加反应,高于T2),SO3 的产率将______选填“增大”“减小”“不变”“无法确定”),理由是_____。
2SO3(g)的平衡常数K=_____。若向该容器通入高温 He(g)(不参加反应,高于T2),SO3 的产率将______选填“增大”“减小”“不变”“无法确定”),理由是_____。
③结合化学方程式及相关文字,解释反应为什么在 T3 条件下比 T2 条件下的速率慢:__________。
(4)T2 时使用 V2O5 进行反应:2SO2(g)+O2(g)![]() 2SO3(g),在保证 O2(g)的浓度不变的条件下,增大容器的体积,平衡_____(填字母代号)。
2SO3(g),在保证 O2(g)的浓度不变的条件下,增大容器的体积,平衡_____(填字母代号)。
A.向正反应方向移动 B.不移动 C.向逆反应方向移动 D.无法确定
【答案】-195.2kJ/mol 减小 常温下,V2O5 (s)+SO2 (g)![]() V2 O4 (s)+SO3 (g)和2SO2(g)+O2(g)
V2 O4 (s)+SO3 (g)和2SO2(g)+O2(g)![]() 2SO3(g)反应都很慢 < 1.89×104 减小 该反应为气体体积减小的放热反应,通入高温He相当于加热;同时容器的体积增大,相当于减小压强,平衡均左移,产率减小 该反应正向为放热反应,平衡时温度越高,SO2的转化率越低,故T3比T2高,高温下,反应②平衡向左移动,生成的V2O4固体覆盖在V2O5固体的表面,减小了V2O5与SO2气体的接触面积,使得V2O5 (s)+SO2 (g)
2SO3(g)反应都很慢 < 1.89×104 减小 该反应为气体体积减小的放热反应,通入高温He相当于加热;同时容器的体积增大,相当于减小压强,平衡均左移,产率减小 该反应正向为放热反应,平衡时温度越高,SO2的转化率越低,故T3比T2高,高温下,反应②平衡向左移动,生成的V2O4固体覆盖在V2O5固体的表面,减小了V2O5与SO2气体的接触面积,使得V2O5 (s)+SO2 (g)![]() V2 O4 (s)+SO3 (g)的反应速率降低 B
V2 O4 (s)+SO3 (g)的反应速率降低 B
【解析】
(1)结合已知热化学方程式,根据盖斯定律进行计算;
(2)由图像可知,随反应前加入 O2 量的变化,SO2未参与反应,V2O4逐渐减少,V2O5逐渐增多,根据反应条件和反应方程式分析反应的发生;
(3)①温度越高,反应速率越大;
②由图像可知,在T2温度下,该反应达到平衡状态时,SO2的转化率为90%,则可列出三段式,计算平衡时气体总物质的量,再根据恒温恒压下,气体的体积之比等于物质的量之比可得,计算平衡时容器的体积,从而计算平衡时气体的浓度,进而计算该反应的平衡常数;通入高温He相当于加热,同时容器的体积会增大,再结合平衡移动规律分析;
③结合平衡移动规律以及V2O5催化反应2SO2(g)+O2(g)![]() 2SO3(g)的历程分析原因;
2SO3(g)的历程分析原因;
(4)根据V2O5催化反应2SO2(g)+O2(g)![]() 2SO3(g)的历程分析。
2SO3(g)的历程分析。
(1)已知热化学方程式①V2O5 (s)+SO2 (g)![]() V2 O4 (s)+SO3 (g) △H1=+59.6kJ·mol-1;②2V2O4(s)+O2(g)
V2 O4 (s)+SO3 (g) △H1=+59.6kJ·mol-1;②2V2O4(s)+O2(g)![]() 2V2O5(s) △H2=-314.4kJ·mol-1;根据盖斯定律可知,由2×①+②可得目标方程式2SO2(g)+O2(g)
2V2O5(s) △H2=-314.4kJ·mol-1;根据盖斯定律可知,由2×①+②可得目标方程式2SO2(g)+O2(g)![]() 2SO3(g),则△H3=2△H1+△H2=+59.6kJ·mol-1×2-314.4kJ·mol-1=-195.2kJ/mol,降低温度,反应速率会减小,故答案为:-195.2kJ/mol;减小;
2SO3(g),则△H3=2△H1+△H2=+59.6kJ·mol-1×2-314.4kJ·mol-1=-195.2kJ/mol,降低温度,反应速率会减小,故答案为:-195.2kJ/mol;减小;
(2)由图像可知,随反应前加入 O2 量的变化,SO2未参与反应,V2O4逐渐减少,V2O5逐渐增多,由此可知,容器中发生反应2V2O4(s)+O2(g)![]() 2V2O5(s),而反应V2O5 (s)+SO2 (g)
2V2O5(s),而反应V2O5 (s)+SO2 (g)![]() V2 O4 (s)+SO3 (g)和2SO2(g)+O2(g)
V2 O4 (s)+SO3 (g)和2SO2(g)+O2(g)![]() 2SO3(g)几乎没有发生,可能是在常温下反应都很慢,则没有生成SO3,故答案为:常温下,V2O5 (s)+SO2 (g)
2SO3(g)几乎没有发生,可能是在常温下反应都很慢,则没有生成SO3,故答案为:常温下,V2O5 (s)+SO2 (g)![]() V2 O4 (s)+SO3 (g)和2SO2(g)+O2(g)
V2 O4 (s)+SO3 (g)和2SO2(g)+O2(g)![]() 2SO3(g)反应都很慢;
2SO3(g)反应都很慢;
(3)①由图像可知,在T2温度下,该反应先达到平衡状态,则反应速率更大,且该反应正向为放热反应,升高温度,平衡逆向移动,SO2的转化率降低,则T2温度更高,故答案为:<;
②由图像可知,在T2温度下,该反应达到平衡状态时,SO2的转化率为90%,则SO2的转化量为0.54mol,可列出三段式(单位为mol) ,则平衡时气体总物质的量为0.06mol+0.03mol+0.54mol=0.63mol,设平衡时容器的体积为V,根据恒温恒压下,气体的体积之比等于物质的量之比可得,
,则平衡时气体总物质的量为0.06mol+0.03mol+0.54mol=0.63mol,设平衡时容器的体积为V,根据恒温恒压下,气体的体积之比等于物质的量之比可得,![]() ,解得,V=7L,则该反应的平衡常数
,解得,V=7L,则该反应的平衡常数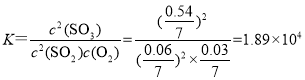 ;由于该反应为气体体积减小的放热反应,通入高温He相当于加热,同时容器的体积会增大,相当于减小压强,平衡均左移,产率减小,故答案为:1.89×104;减小;该反应为气体体积减小的放热反应,通入高温He相当于加热,同时容器的体积增大,相当于减小压强,平衡均左移,产率减小;
;由于该反应为气体体积减小的放热反应,通入高温He相当于加热,同时容器的体积会增大,相当于减小压强,平衡均左移,产率减小,故答案为:1.89×104;减小;该反应为气体体积减小的放热反应,通入高温He相当于加热,同时容器的体积增大,相当于减小压强,平衡均左移,产率减小;
③该反应正向为放热反应,平衡时温度越高,SO2的转化率越低,故T3比T2高,高温下,反应②平衡向左移动,生成的V2O4固体覆盖在V2O5固体的表面,减小了V2O5与SO2气体的接触面积,使得V2O5 (s)+SO2 (g)![]() V2 O4 (s)+SO3 (g)的反应速率降低,故答案为:该反应正向为放热反应,平衡时温度越高,SO2的转化率越低,故T3比T2高,高温下,反应②平衡向左移动,生成的V2O4固体覆盖在V2O5固体的表面,减小了V2O5与SO2气体的接触面积,使得V2O5 (s)+SO2 (g)
V2 O4 (s)+SO3 (g)的反应速率降低,故答案为:该反应正向为放热反应,平衡时温度越高,SO2的转化率越低,故T3比T2高,高温下,反应②平衡向左移动,生成的V2O4固体覆盖在V2O5固体的表面,减小了V2O5与SO2气体的接触面积,使得V2O5 (s)+SO2 (g)![]() V2 O4 (s)+SO3 (g)的反应速率降低;
V2 O4 (s)+SO3 (g)的反应速率降低;
(4)T2 时使用 V2O5 进行反应:2SO2(g)+O2(g)![]() 2SO3(g),实际上反应的过程为①V2O5 (s)+SO2 (g)
2SO3(g),实际上反应的过程为①V2O5 (s)+SO2 (g)![]() V2 O4 (s)+SO3 (g),②2V2O4(s)+O2(g)
V2 O4 (s)+SO3 (g),②2V2O4(s)+O2(g)![]() 2V2O5(s),反应①为反应前后气体物质的量不变的反应,增大容器的体积,即减小压强,平衡不移动,对于反应②,由于氧气的浓度不变,则平衡也不移动,故2SO2(g)+O2(g)
2V2O5(s),反应①为反应前后气体物质的量不变的反应,增大容器的体积,即减小压强,平衡不移动,对于反应②,由于氧气的浓度不变,则平衡也不移动,故2SO2(g)+O2(g)![]() 2SO3(g)不移动,故答案为:B。
2SO3(g)不移动,故答案为:B。