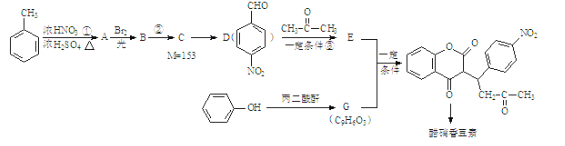
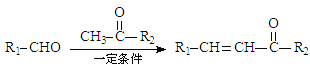
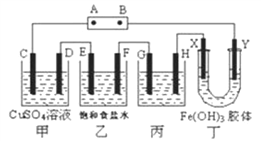
题目内容
【题目】只要用一种试剂,可区别NaCl、MgSO4、FeCl2、FeCl3四种溶液,这种试剂是( )
A.HCl
B.NaOH
C.AgNO3
D.BaCl2
【答案】B
【解析】解:A.均与HCl不反应,不能鉴别,故A不选; B.NaCl、MgSO4、FeCl2、FeCl3四种溶液分别与NaOH反应的现象为:无现象、白色沉淀、白色沉淀变为灰绿色最后为红褐色、红褐色沉淀,可鉴别,故B选;
C.均与硝酸银反应生成白色沉淀,不能鉴别,故C不选;
D.只有MgSO4与氯化钡反应,不能鉴别,故D不选;
故选B.

 芒果教辅暑假天地重庆出版社系列答案
芒果教辅暑假天地重庆出版社系列答案【题目】25℃时,常见的无机酸在水溶液中的电离子平衡常数如表,下列选项正确的是( )
氢氰酸(HCN) | 碳酸(H2C03) | 氢氟酸(HF) |
K=4.9×10﹣10 | K1=4.4×10﹣7 K2=4.7×10﹣11 | K=6.61×10﹣4 |
A. 氰化钠溶液中通入少量CO2:2CN﹣+H2O+CO2═2HCN+CO32﹣
B. NaCN与HCN的混合溶液中一定有:c(Na+)>c(CN﹣)>c(HCN)>c(H+)>c(OH-)
C. 25℃时CN-的水解平衡常数约为1.6×10-5
D. NaCN与HCN的混合溶液中:2c(Na+)=c(CN-)+c(HCN)
【答案】C
【解析】A、根据电离平衡常数知,酸性H2CO3>HCN>HCO3-,结合强酸制取弱酸知,氰化钠溶液中通入少量CO2只能发生以下反应CN﹣+H2O+CO2=HCN+ HCO3-,故A错误;B、NaCN溶液显碱性,HCN溶液显酸性,选项中没有已知混合时NaCN与HCN量的相对大小,无法判断溶液的酸碱性,也无法判断离子浓度大小,故B错误;C、HCN的电离常数K与CN的水解常数Kh的乘积等于Kw,则有Kh=![]() ≈1.6×10-5,故C正确;D、等体积等浓度的NaCN溶液与HCN溶液混合所得溶液的物料守恒为:2c(Na+)=c(CN)+c(HCN),而选项中没有已知NaCN与HCN量的相对大小,无法判断,故D错误。故选C。
≈1.6×10-5,故C正确;D、等体积等浓度的NaCN溶液与HCN溶液混合所得溶液的物料守恒为:2c(Na+)=c(CN)+c(HCN),而选项中没有已知NaCN与HCN量的相对大小,无法判断,故D错误。故选C。
【题型】单选题
【结束】
19
【题目】室温下,向20.00 mL 0.8molL﹣1一元酸HA溶液中滴入0.8 molL﹣1的NaOH溶液,溶液的pH和温度随加入NaOH溶液体积的变化曲线如图所示.下列有关说法正确的是( )
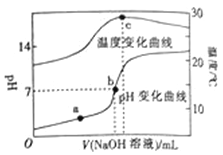
A. 常温下,1.0 molL﹣1HA的溶液的pH=0
B. a、b、c三点,a点混合溶液中c(Na+)最大
C. a、b两点的溶液中水的离子积Kw(a)=Kw(b)
D. c点时消耗NaOH溶液的体积为20.00mL