题目内容
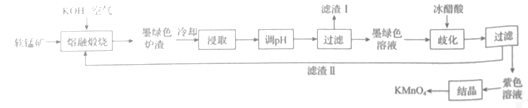
【题目】硝酸工业与合成氨工业密切相关,氨氧化法是工业生产中制取硝酸的主要途径,其主要流程如图:
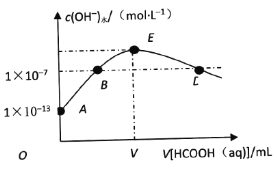
I. 在一容积为2L的密闭容器内加入2molN2和6molH2,在一定条件下合成氨气,已知N2(g)+3H2(g)![]() 2NH3 △H<0。反应中NH3的物质的量浓度的变化情况如图所示
2NH3 △H<0。反应中NH3的物质的量浓度的变化情况如图所示

(1)根据图示,计算从反应开始到第4分钟达到平衡时,平均反应速率υ(N2)为______
(2)达到平衡后,第5分钟末,若保持其它条件不变,只改变反应温度,则NH3的物质的量浓度不可能为________(填序号)。
a. 0. 8mol/L b.1.0mol/L. c.1.2mol/L d. 2. mol/L
(3)达到平衡后,第5分钟末,若保持其它条件不变,只把容器的体积缩小,新平衡时NH3的浓度恰好为原来的2倍,则新体积_________(选填“大于”“等于”或“小于”)二分之一倍的原体积。
Ⅱ.某小组同学欲探究由NH3制取HNO3的过程,设计按如图所示装置进行试验。
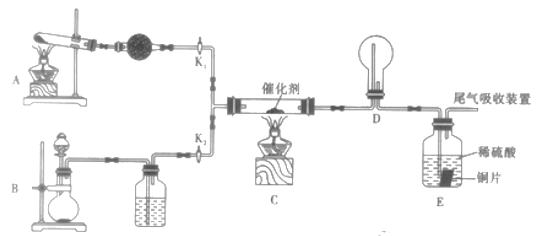
(1)A装置中发生反应的化学方程式为_________________________________。
(2)B装置制备的物质为_________________。(填序号)
A . NH3 B Cl2 C.O2 D. HCl
(3)该实验中能够证明有二氧化氮产生的现象为_______________________。
(4)已知E中装有2mol/L的硫酸150mL和足量铜片,若E中出现溶液变蓝色的现象,所有反应的铜均转化为CuSO4,则至少需要产生标况下_______L氨气(假设各步反应均完全进行)。
【答案】0.125mol·L1·min1 bd 大于 Ca(OH)2+2NH4Cl![]() CaCl2 + 2NH3↑+2H2O C D中出现红棕色气体 4.48
CaCl2 + 2NH3↑+2H2O C D中出现红棕色气体 4.48
【解析】
Ⅰ.(1)4分钟达平衡时由图可知c(NH3)=1.0mol/L,则4分钟内N2的浓度变量为0.5mol/L,所以υ(N2)=0.125mol·L1·min1;
(2)由于反应不能完全进行,所以NH3的物质的量浓度不可能为2.0mol/L,无论是升温还是降温反应平衡均将移动,所以不能为1.0mol/L。选择bd两个选项。
(3)假设改变容器的体积,平衡不移动,则要使NH3的浓度恰好为原来的2倍,容器体积将缩小为原来的1/2,但是该反应正向为气体体积缩小的反应,容器的体积缩小后平衡将正向移动,所以缩小后体积将大于原体积的1/2。
Ⅱ.(1)由于干燥氨气只能选择碱石灰,所以A装置必须为制取氨气的装置,根据装置特征可判断为固固加热制气体的反应,所以发生的反应为Ca(OH)2+2NH4Cl![]() CaCl2+ 2NH3↑+2H2O。
CaCl2+ 2NH3↑+2H2O。
(2)因为NH3制取HNO3的过程需要氧气参加反应,所以除制取NH3外,还需要制备氧气,所以选C。
(3)在C装置中,NH3催化氧化变成NO,在D中与O2反应生成NO2,呈红棕色能说明有NO2生成。
(4)若E中所有反应的铜均转化为CuSO4,则说明生成的HNO3全部作氧化剂,由于反应方程式为3Cu+2HNO3+3H2SO4=3CuSO4+2NO↑+4H2O,E中硫酸为0.3mol,所以消耗的HNO3为0.2mol,由于各步反应完全转化,所以根据氮元素守恒,所需NH3的最小值为0.2mol,标况下的体积为4.48L。

【题目】已知25℃时部分弱电解质的电离平衡常数数据如表所示,回答下列问题:
化学式 | CH3COOH | H2CO3 | HClO |
电离平衡常数 | Ka=1.8×10﹣5 | Ka1=4.3×10﹣7 Ka2=5.6×10﹣11 | Ka=3.0×10﹣8 |
(1)物质的量浓度均为0.1molL﹣1的四种溶液:pH由小到大排列的顺序是_______(用编号填写)
a.CH3COONa b.Na2CO3 c.NaClO d.NaHCO3
(2)常温下,0.1molL﹣1 CH3COOH溶液加水稀释过程中,下列表达式的数据变大的是_____(填字母)_______
A. c(H+) B.![]() C. c(H+)c(OH﹣) D.
C. c(H+)c(OH﹣) D. ![]() E.
E. ![]()
(3)写出向次氯酸钠溶液中通入少量二氧化碳的离子方程式:__________________
(4)25℃时,CH3COOH与CH3COONa的混合溶液,若测得混合液pH=6,则溶液中
c(CH3COO﹣)﹣c(Na+)=________(填准确数值)。
(5)25℃时,将a molL﹣1的醋酸与b molL﹣1氢氧化钠等体积混合,反应后溶液恰好显中性,用a、b表示醋酸的电离平衡常数为____________________________________
(6)标准状况下,将1.12L CO2通入100mL 1molL﹣1的NaOH溶液中,用溶液中微粒的浓度符号完成下列等式: c(OH﹣)=2c(H2CO3)+_________________________