题目内容
有一未知的无色溶液,只可能含有以下离子中的若干种(忽略由水电离产生的H+、OH-):H+、NH4+、K+、Mg2+、Cu2+、Al3+、NO3-、CO32-、SO42-,现取三份100mL溶液进行如下实验: ①第一份加足量AgNO3溶液后,有白色沉淀产生。②第二份加足量BaCl2溶液后,有白色沉淀产生,经洗涤、干燥后,沉淀质量为6.99 g。③第三份逐滴滴加NaOH溶液,测得沉淀与NaOH溶液的体积关系如图。根据上述实验,以下推测不正确的是 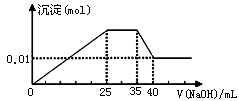
| A.原溶液一定不存在H+、Cu2+、CO32- |
| B.不能确定原溶液是否含有K+、NO3- |
| C.实验所加的NaOH的浓度为2mol·L-1 |
| D.原溶液确定含Mg2+、Al3+、NH4+,且n(Mg2+):n(Al3+):n( NH4+)=1:1:2 |
B
解析试题分析:由于原溶液是无色的,所以不能含有蓝色Cu2+离子。根据实验①证明可能含有CO32-、SO42-中的一种或两种离子;根据实验②证明可能含有CO32-、SO42-中的一种或两种离子;根据实验③证明原溶液中含有Al3+。会发生反应:Al3++3OH-=Al(OH)3↓;当NaOH过量时,发生反应:Al(OH)3+ OH-= AlO2-+ 2H2O。由这两个离子方程式可以看出:Al3+形成沉淀与沉淀溶解消耗的NaOH的体积比应该是3:1,而图像显示形成沉淀消耗的NaOH体积多,说明还含有其它能与NaOH反应产生沉淀的微粒,证明是含有Mg2+。n(Mg2+)=0.01mol;根据体积关系可知产生0.01mol Mg(OH)2沉淀需要NaOH溶液的体积为10ml,所以0.01L×c(NaOH)÷2=0.01mol. c(NaOH)= 2mol/L. n(Al3+)= 2mol/L×0.005mol/L=0.01mol.由于加入NaOH,立即产生沉淀,则说明溶液中无H+;由于Al3+会与CO32- 发生双水解反应,因此溶液中不含CO32-离子。在沉淀达到最大值后,加入NaOH,沉淀不是立刻减少,说明含有与OH-反应的微粒。根据题目提供的微粒,只能是NH4+。n( NH4+)= 2mol/L×0.01mol/L=0.02mol.所以n(Mg2+):n(Al3+):n( NH4+)=1:1:2。结合实验③可知与BaCl2产生沉淀的微粒是SO42-,其物质的量为n(SO42-)= 6.99 g÷233g/mol=0.03mol.在该溶液中阳离子带的正电荷总数是:0.01×2+0.01×3+0.02×1=0.07mol; SO42-带的负电荷总数为0.03mol×2="0.06mol" < 0.07mol,所以根据电荷守恒可确定溶液中还含有阴离子NO3-。但是不能确定K+是否存在。综上所述,错误的选项是B。
考点:考查离子的鉴定、溶液成分的确定的知识。

在水溶液中能大量共存的一组离子是( )
| A.Na+、Ba2+、Cl—、NO3— | B.Pb2+、Hg2+、S2—、SO42— |
| C.NH4+、H+、S2O32—、PO43— | D.Ca2+、Al3+、Br—、CO32— |
常温下,下列各组离子在指定溶液中一定能大量共存的是( )
A.c(H+)/c(OH-)=1×1014的溶液:Fe2+、K+、HSO 、ClO- 、ClO- |
B.0.1 mol·L-1FeCl3溶液:NH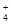 、H+、I-、SCN- 、H+、I-、SCN- |
C.0.1 mol·L-1Na2CO3溶液:K+、Ca2+、HCO 、SO 、SO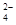 |
D.使酚酞变红色的溶液:Na+、Ba2+、NO 、Cl- 、Cl- |
常温时,下列各组离子能大量共存的是
A.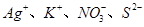 | B.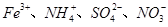 |
C.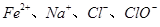 | D. |
在水溶液中能大量共存的一组是
| A.Fe2+、Na+、ClO-、Cl- | B.Al3+、Mg2+、SO42-、CO32- |
| C.H+、Ca2+、Cl-、NO3- | D.AlO2-、Cl-、H+、K+ |
下列反应的离子方程式正确的是( )
| A.向AgNO3溶液中滴加氨水至过量:Ag++NH3·H2O=AgOH↓+NH4+ |
| B.向Mg(OH)2悬浊液中滴加FeCl3溶液:3Mg(OH)2+2Fe3+=2Fe(OH)3+3Mg2+ |
| C.向Na2S2O3溶液中加入足量稀硫酸:2S2O32-+4H+=SO42-+3S↓+2H2O |
D.向苯酚钠溶液中通入少量CO2气体: |
常温下,下列各组离子在指定溶液中一定能大量共存的是
| A.0.1 mol·L-1 NaHSO4溶液:K+、Fe2+、NO3-、Cl- |
| B.0.1 mol·L-1NaAlO2的溶液:K+、Na+、SO42-、CO32- |
| C.无色溶液:Ba 2+、Na+、MnO4-、NO3- |
| D.由水电离出的c(OH-)=1.0×10-12 mol·L-1的溶液:NH4+、HCO3-、Na+、Cl- |
下列反应的离子方程式中,正确的是
| A.NH4HCO3溶液与过量NaOH溶液反应:NH4+ + OH- = NH3·H2O |
| B.在苯酚的乳浊溶液中滴加碳酸钠溶液变澄清:2C6H5OH + CO32- → CO2↑+ 2C6H5O- + H2O |
C.用两根铜棒作电极电解盐酸:2H+ + 2Cl-  H2↑ + Cl2↑ H2↑ + Cl2↑ |
| D.SO2通入次氯酸钠溶液中:SO2 + ClO-+ H2O = SO42- + Cl-+ 2H+ |
根据表中信息,判断下列叙述中正确的是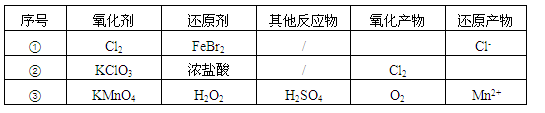
| A.表中①组的反应只可能有一种元素被氧化和一种元素被还原 |
| B.氧化性强弱的比较: KClO3>Fe3+>Cl2>Br2 |
| C.由表中①②组反应推测:ClO3-、Br-、H+、Fe2+不能在浓溶液中大量共存 |
| D.表中③组反应的离子方程式为:2MnO4-+ 3H2O2 + 6H+=2Mn2+ + 4O2↑+ 6H2O |