题目内容
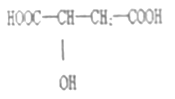
【题目】聚合化铝是一种新型、高效絮凝剂和净水剂,其单体是液态的碱式氯化铝Al2(OH)nCl6-n。本实验采用铝盐溶液水解絮凝法制备碱式氯化铝。其制备原料为分布广、价格廉的高岭土,化学组成为:Al2O3(25%~34%)、SiO2(40%~50%)、Fe2O3(0.5%~3.0%)以及少量杂质和水分。已知氧化铝有多种不同的结构,化学性质也有差异,且一定条件下可相互转化;高岭土中的氧化铝难溶于酸。制备碱式氯化铝的实验流程如下:
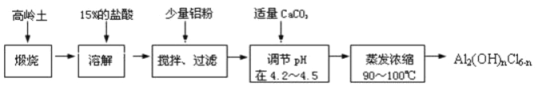
根据流程图回答下列问题:
(1)“煅烧”的目的是 。
(2)配制质量分数15%的盐酸需要200ml30%的浓盐酸(密度约为1.15g·cm-3)和 g蒸馏水,配制用到的仪器有 。
(3)“溶解”过程中发生反应的离子方程式为 。
(4)加少量铝粉的主要作用是 。
(5)“蒸发浓缩”需保持温度在90~100℃,控制温度的实验方法是 。
(6)若溶解过程改为加入一定浓度的氢氧化钠溶液,发生反应的离子方程式为 。
【答案】(1)改变高岭土的结构,使其能溶于酸(1分)
(2)230(1分)烧杯、玻璃棒、量筒(2分)
(3)Al2O3+6H+=2Al3++3H2O(1分)Fe2O3+6H+=2Fe3++3H2O(1分)
(4)除去溶液中的铁离子(1分)(5)水浴加热(1分)
(6)Al2O3+2OH-=2AlO2-+H2O(1分)SiO2+2OH-=SiO32-+H2O(1分)
【解析】
试题分析:(1)高岭土的化学组成为:Al2O3(25%~34%)、SiO2(40%~50%)、Fe2O3(0.5%~3.0%)以及少量杂质和水分,“煅烧”的目的是改变高岭土的结构,使其能溶于酸。
(2)设需要蒸馏水x g,根据稀释前后溶质的质量不变可列方程为:200×1.15×30%==(200×1.15+x)×15%,解得x=230g。即需要蒸馏水230克;配制用到的仪器有烧杯、玻璃棒、量筒。
(3)溶解过程加入了稀盐酸,高岭土中的氧化铝、氧化铁与稀盐酸反应生成盐和水,则反应的离子方程式为Al2O3+6H+=2Al3++3H2O、 Fe2O3+6H+=2Fe3++3H2O。
(4)铝比铁活泼,铝与Fe3+反应生成Al3+和铁单质,所以加少量铝粉的主要作用是除去溶液中的铁离子。
(5)“蒸发浓缩”需保持温度在90~100℃,控制温度的实验方法是水浴加热。
(6)高岭土中的氧化铝和SiO2均和NaOH溶液反应,所以溶解过程改为加入一定浓度的氢氧化钠溶液,发生反应的离子方程式为Al2O3+2OH-=2AlO2-+H2O、SiO2+2OH-=SiO32-+H2O。