题目内容
【题目】高铁酸钾广泛应用于净水、电池工业等领域。工业上以钛白粉生产的副产品FeSO4制备高铁酸钾的生产流程如下:

查资料得知K2FeO4的一些性质:
①在碱性环境中稳定,在中性和酸性条件下不稳定。
②在水中溶解度很大,难溶于无水乙醇等有机溶剂。
回答下列问题:
(1)写出氧化I中,生成Fe3+的离子反应方程式:
(2)氧化II中,试剂A为 (填“H2O2”或“HNO3”或“NaC1O”),反应的离子方程式为_____________________。
(3)操作I中包括冷却结晶,过滤洗涤、干燥几个步骤,洗涤干燥的目的是脱碱脱水,进行洗涤操作时应该用 洗涤。
(4)净水时高铁酸钾能逐渐与水反应生成絮状的Fe(OH)3,请补充并配平该反应方程式的系数及产物:
______K2FeO4 + H2O ![]() Fe(OH)3(胶体)+ KOH + 。
Fe(OH)3(胶体)+ KOH + 。
将一定量的K2FeO4投入一定浓度的FeC13溶液中,测得剩余K2FeO4浓度如下图所示,推测产生曲线I和曲线II差异的原因是: 。

(5)制得的粗K2FeO4产品中常混有少量KCl。取5.0 g粗产品溶于足量稀硝酸,充分反应后,加入足量的硝酸银,过滤得到沉淀,洗涤、干燥,称量得到1.435 g固体,K2FeO4的质量分数为___________。(可能用到的相对原子质量:O 16 Cl 35.5 K 39 Fe 56 Ag 108)
【答案】
(1)H2O2+2H++2Fe2+=2Fe3++2H2O;
(2)NaClO;2Fe3++3ClO-+10OH-=2FeO42-+5H2O+3Cl-;
(3)无水乙醇;
(4)4;10;4;8;3O2↑;FeCl3溶液水解显酸性,促进K2FeO4与水反应从而降低K2FeO4的浓度;
(5)85.1%;
【解析】
试题分析:(1)氧化I中,双氧水将亚铁离子氧化生成Fe3+的离子反应方程式为H2O2+2H++2Fe2+=2Fe3++2H2O,故答案为:H2O2+2H++2Fe2+=2Fe3++2H2O;
(2)氧化II中,试剂A将Fe3+氧化为FeO42-,结合题意和信息,应该选用NaC1O,防止生成的K2FeO4分解,反应的离子方程式为2Fe3++3ClO- +10OH- = 2FeO42- + 5H2O + 3Cl-,故答案为:NaClO;2Fe3++3ClO- +10OH- = 2FeO42- + 5H2O + 3Cl- ;
(3)根据信息,K2FeO4在水中溶解度很大,难溶于无水乙醇等有机溶剂。操作I应该选用无水乙醇进行洗涤,故答案为:无水乙醇;
(4)净水时高铁酸钾能逐渐与水反应生成絮状的Fe(OH)3,根据得失电子守恒,配平后的方程式为4K2FeO4 +10H2O ![]() 4Fe(OH)3(胶体)+8KOH + 3O2↑;将一定量的K2FeO4投入一定浓度的FeC13溶液中,由于FeCl3溶液水解显酸性,促进K2FeO4与水反应从而降低K2FeO4的浓度,故答案为:4;10;4;8;3O2↑;FeCl3溶液水解显酸性,促进K2FeO4与水反应从而降低K2FeO4的浓度;
4Fe(OH)3(胶体)+8KOH + 3O2↑;将一定量的K2FeO4投入一定浓度的FeC13溶液中,由于FeCl3溶液水解显酸性,促进K2FeO4与水反应从而降低K2FeO4的浓度,故答案为:4;10;4;8;3O2↑;FeCl3溶液水解显酸性,促进K2FeO4与水反应从而降低K2FeO4的浓度;
(5)生成氯化银的质量为1.435 g,物质的量为![]() =0.01mol,可以氯化钾的质量为0.01mol×74.5g/mol=0.745g,K2FeO4的质量分数为
=0.01mol,可以氯化钾的质量为0.01mol×74.5g/mol=0.745g,K2FeO4的质量分数为![]() ×100%=85.1%,故答案为:85.1%。
×100%=85.1%,故答案为:85.1%。

 名校课堂系列答案
名校课堂系列答案【题目】汽车尾气中的主要污染物是NO和CO。为减轻大气污染,人们提出通过以下反应来处理汽车尾气:
(1)2NO(g)+2CO(g)![]() 2CO2(g)+N2(g)△H=﹣746.5kJmol-1(条件为使用催化剂)
2CO2(g)+N2(g)△H=﹣746.5kJmol-1(条件为使用催化剂)
已知:2C(s)+O2(g)![]() 2CO(g)△H=﹣221.0kJmol-1
2CO(g)△H=﹣221.0kJmol-1
C(s)+O2(g)![]() CO2(g)△H=﹣393.5kJmol-1
CO2(g)△H=﹣393.5kJmol-1
则N2(g)+O2(g)=2NO(g) △H = kJmol-1。
(2)T ℃下,在一容积不变的密闭容器中,通入一定量的NO和CO,用气体传感器测得不同时间NO和CO的浓度如下表
时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
c(NO)/10-4 mol/L | 10.0 | 4.50 | c1 | 1.50 | 1.00 | 1.00 |
c(CO)/10-3 mol/L | 3.60 | 3.05 | c2 | 2.75 | 2.70 | 2.70 |
则c2合理的数值为 (填字母标号)。
A.4.20 B.4.00 C.2.95 D.2.80
(3)将不同物质的量的H2O(g)和CO(g)分别通入体积为2 L的恒容密闭容器中,进行反应:H2O(g)+CO(g)![]() CO2(g)+H2(g),得到如下三组数据:
CO2(g)+H2(g),得到如下三组数据:
实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
H2O | CO | CO | H2 | |||
i | 650 | 2 | 4 | 2.4 | 1.6 | 5 |
ii | 900 | 1 | 2 | 1.6 | 0.4 | 3 |
iii | 900 | a | b | c | d | t |
若a=2,b=1,则c= ,达平衡时实验组ii中H2O(g)和实验组iii中CO的转化率的关系为αii(H2O) αiii(CO)(填“<”、“>”或“=”)。
(4)二甲醚是清洁能源,用CO在催化剂存在下制备二甲醚的反应原理为:2CO(g)+4H2(g)![]() CH3OCH3(g)+H2O(g),已知一定条件下,该反应中CO的平衡转化率随温度、投料比
CH3OCH3(g)+H2O(g),已知一定条件下,该反应中CO的平衡转化率随温度、投料比![]() 的变化曲线如图1所示。
的变化曲线如图1所示。
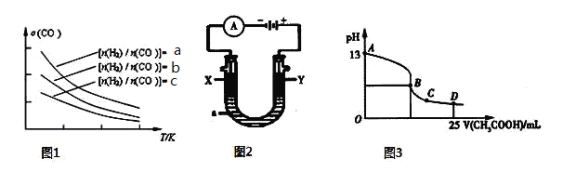
① a、b、c按从大到小的顺序排序为 。
② 根据图象可以判断该反应为 反应(填吸热或放热)。
(5)CO分析仪的传感器可测定汽车尾气是否符合排放标准,该分析仪的工作原理类似于燃料电池,其中电解质是氧化钇(Y2O3)和氧化锆(ZrO2)晶体,能传导O2-。
① 负极的电极反应式为 。
② 以上述电池为电源,通过导线连接成图2。若X、Y为石墨,a为2 L 0.1 mol/L KCl溶液电解一段时间后,取25 mL 上述电解后的溶液,滴加0.4 mol/L醋酸得到图3曲线(不考虑能量损失和气体溶于水,溶液体积变化忽略不计)。根据图2计算,上述电解过程中消耗一氧化碳的质量为 g。