题目内容
【题目】下列各表述与示意图一致的是( )
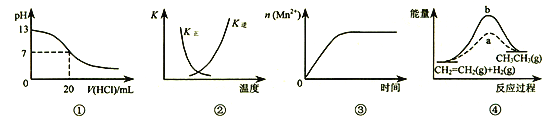
A. 图①表示25℃时,用0.1mol/L盐酸滴定20 mL0.1mol/LNaOH溶液,溶液的pH随加入酸体积的变化
B. 图②中曲线表示反应2SO2(g)+O2(g)![]() 2SO3(g) ΔH<0 正、逆反应的平衡常数K随温度的变化
2SO3(g) ΔH<0 正、逆反应的平衡常数K随温度的变化
C. 图③表示10 mL 0.01 mol/L KMnO4 酸性溶液与过量的0.1mol/L H2C2O4溶液混合时,n(Mn2+) 随时间的变化(Mn2+对该反应有催化作用,且是放热反应)
D. 图④中a、b曲线分别表示反应CH2=CH2(g)+H2(g)![]() CH3CH3(g) ΔH< 0使用和未使用催化剂时,反应过程中的能量变化
CH3CH3(g) ΔH< 0使用和未使用催化剂时,反应过程中的能量变化
【答案】B
【解析】
A.酸碱中和滴定时,有pH的突变过程,图①中没有,A错误;
B.反应2SO2(g)+O2(g)![]() 2SO3(g);△H<0,该反应的正反应是放热反应,升高温度,化学平衡逆向移动,所以正反应的平衡常数随温度的升高而减小,逆反应是吸热反应,升高温度,逆反应的平衡常数增大,B正确;
2SO3(g);△H<0,该反应的正反应是放热反应,升高温度,化学平衡逆向移动,所以正反应的平衡常数随温度的升高而减小,逆反应是吸热反应,升高温度,逆反应的平衡常数增大,B正确;
C.高锰酸钾被草酸还原生成Mn2+,Mn2+为反应的催化剂,但开始时产生Mn2+的物质的量增大增大的速率没有这么大,C错误;
D.图象中使用催化剂降低反应活化能,但反应是放热反应,反应物能量高,图象中表示的吸热反应,D错误;
故合理选项是B。

练习册系列答案
相关题目



