题目内容
【题目】铜是人类最早使用的金属之一。能形成多种化合物,易形成配位化合物。回答下列问题:
(1)Cu位于周期表第四周期第___族。写出其基态原子的电子排布式_____。
(2)元素Ni和Cu如相邻
①Ni和Cu相比,基态原子中未成对电子___.(填“多”“少”或“相等”)。
②第二电离能Cu比Ni高,原因是_____。
(3)Cu可以和EDA( )形成配合物,其中碳原子的杂化方式是____,其中C、N、O的电负性由大到小的顺序是_____。
)形成配合物,其中碳原子的杂化方式是____,其中C、N、O的电负性由大到小的顺序是_____。
(4)CuSO4受热分解的方程式为2CuSO4===Cu2O+SO2↑+SO3↑+O2↑。
①SO2的空间构型为_____,O2中σ和![]() 健的个数比是______。
健的个数比是______。
②氧化亚铜的晶胞结如图所示,其中A原子坐标是(0,0,0),C原子坐标是(![]() ,
,![]() ,
,![]() ),则B原子坐标是____。若最近的Cu+与O2-的核距是anm,用NA表示阿伏加德罗常数的值,则氧化亚铜的密度是_____g·cm—3
),则B原子坐标是____。若最近的Cu+与O2-的核距是anm,用NA表示阿伏加德罗常数的值,则氧化亚铜的密度是_____g·cm—3

【答案】ⅠB 1s22s22p63s23p63d104s1 多 Cu+的价电子排布式为3d10,比Ni的稳定 sp2、sp3杂化 O、N、C V形 1∶1 (![]() ,
,![]() ,
,![]() )
) 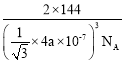
【解析】
(1)根据元素周期表,推出Cu位于周期表第四周期ⅠB族,其基态原子电子的排布式是1s22s22p63s23p63d104s1或[Ar] 3d104s1;
答案是ⅠB;1s22s22p63s23p63d104s1或[Ar] 3d104s1;
(2)①Ni和Cu相比,Ni的价电子排布式为3d84s2,Ni的基态原子有2个未成对电子,Cu的基态原子只有1个未成对电子,Ni基态原子中未成对电子多;
答案为多;
②Cu+的价电子排布式为3d10,处于全满,而Ni+的价电子排布式为3d84s1,因此Cu+第二电离能比Ni+的稳定;
答案是Cu+的价电子排布式为3d10,比Ni的稳定;
(3)EDTA中“-CH2”中C价层电子对数为4,即杂化类型为sp3,羧基中C的价层电子对数为3,即杂化类型为sp2;同周期从左向右电负性增强,即三种元素的电负性顺序是O>N>C;
答案是sp2、sp3杂化;O>N>C;
(4)①SO2中中心原子S有2个σ键,孤电子对数为![]() =1,即SO2的空间构型为V型;成键原子之间只能形成1个σ键,一般认为O2的结构式为O=O,其中含有一个个σ键和一个π键,即个数比为1:1;
=1,即SO2的空间构型为V型;成键原子之间只能形成1个σ键,一般认为O2的结构式为O=O,其中含有一个个σ键和一个π键,即个数比为1:1;
答案是V型;1:1;
②根据晶胞的结构,B点在A和C连线的中点,根据A和B的坐标,得出B原子的坐标为(![]() ,
,![]() ,
,![]() );根据晶胞的结构,Cu+全部位于晶胞内部,即Cu+个数为4,O2-位于顶点和内部,即O2-的个数为
);根据晶胞的结构,Cu+全部位于晶胞内部,即Cu+个数为4,O2-位于顶点和内部,即O2-的个数为![]() =2,化学式为Cu2O,该晶胞的质量为
=2,化学式为Cu2O,该晶胞的质量为![]() g,晶胞的边长为
g,晶胞的边长为![]() ,根据密度的定义,推出该晶胞的密度是
,根据密度的定义,推出该晶胞的密度是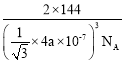 g/cm3;
g/cm3;
答案是(![]() ,
,![]() ,
,![]() );
);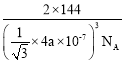 g/cm3。
g/cm3。

【题目】某小组利用H2C2O4 溶液和酸性KMnO4溶液反应来探究“外界条件对化学反应速率的影响”。实验时,先分别量取两种溶液,然后倒入试管中迅速振荡混合均匀,开始计时,通过测定褪色所需时间来判断反应的快慢。该小组设计了如下方案。
实验 编号 | 室温下,试管中所加试剂及其用量/mL | 室温下溶液颜色褪至无色所需时间/min | |||
0.6mol/LH2C2O4溶液 | H2O | 0.2mol/LKMnO4溶液 | 3mol/L稀硫酸 | ||
1 | 3.0 | 2.0 | 2.0 | 3.0 | 4.0 |
2 | 3.0 | 3.0 | 2.0 | 2.0 | 5.2 |
3 | 3.0 | 4.0 | 2.0 | 1.0 | 6.4 |

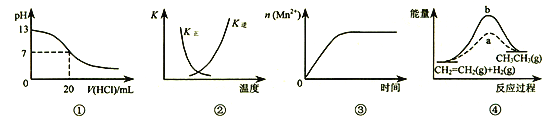
(1)根据上表中的实验数据,可以得到的结论是_______。
(2)该小组同学根据经验绘制了n(Mn2+)随时间变化趋势的示意图,如图1所示。但有同学查阅已有的实验资料发现,该实验过程中n(Mn2+)随时间变化的趋势应如图2所示。该小组同学根据2所示信息提出了新的假设,并继续进行实验探究。
①该小组同学提出的假设是_______。
②请你帮助该小组同学完成实验方案,并填写表中空白。
实验 编号 | 室温下,试管中所加试剂及其用量/mL | 再向试管中加入少量固体X | 室温下溶液颜 色褪至无色所需时间/min | |||
0.6mol/LH2C2O4 溶液 | H2O | 0.2mol/LKMnO4溶液 | 3mol/L稀硫酸 | |||
4 | 3.0 | 2.0 | 2.0 | 3.0 | t | |
固体X是_______。
③若该小组同学提出的假设成立,时间t_______4.0min(填>、=或<)。
(3)为探究温度对化学反应速率的影响,该小组同学准备在上述实验基础上继续进行实验,请你帮助该小组同学完成该实验方案设计_______。