题目内容
【题目】下表是元素周期表的一部分,表中所列的字母分别代表一种元素。
A | |||||||||||||||||
B | C | D | E | F | T | ||||||||||||
G | H | I | J | K | L | ||||||||||||
M | N | O | |||||||||||||||
试回答下列问题(注意:每问中的字母代号为上表中的字母代号,并非为元素符号)
(1)N的单质和水蒸气反应能生成固体X,则I的单质与X反应的化学方程式_______。
(2)D的气态氢化物的VSEPR模型的名称为_______。
(3)由A、C、D形成的ACD分子中,σ键和π键个数比= _______________。
(4)要证明太阳上是否含有R 元素,可采用的方法是__________________________。
(5)元素M的化合物(ME2L2)在有机合成中可作氧化剂或氯化剂,能与许多有机物反应。回答问题:
①ME2L2常温下为深红色液体,能与CCl4、CS2等互溶,据此可判断ME2L2是_________(填“极性”或“非极性”)分子。
②将N和O的单质用导线连接后插入D的最高价氧化物对应的水化物浓溶液中,可制成原电池,则组成负极材料的元素的外围电子轨道表示式为______________________。
(6)往O2+溶液中加入氨水,形成蓝色沉淀,继续加入氨水,难溶物溶解变成蓝色透明溶液,写出沉淀溶解的离子方程式_____。
(7)若F 、K两种元素形成的化合物中中心原子的价电子全部参与成键,则该化合物的空间构型的名称为___。
(8)如图四条折线分别表示ⅣA族、ⅤA族、ⅥA族、ⅦA族元素气态氢化物沸点变化,则E的氢化物所在的折线是__(填m、n、x或y)。

(9)1183 K以下纯N晶体的基本结构单元如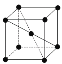 所示,1183 K以上转变为
所示,1183 K以上转变为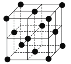 所示结构的基本结构单元。在1183 K以下的晶体中,空间利用率为____;在1183 K以上的晶体中,与N原子等距离且最近的N原子数为____,晶体堆积方式的名称为_____。
所示结构的基本结构单元。在1183 K以下的晶体中,空间利用率为____;在1183 K以上的晶体中,与N原子等距离且最近的N原子数为____,晶体堆积方式的名称为_____。
【答案】8Al+3Fe3O4![]() 4Al2O3+9Fe 四面体 1:1 对太阳光进行光谱分析 非极性
4Al2O3+9Fe 四面体 1:1 对太阳光进行光谱分析 非极性 ![]() Cu(OH)2+4NH3·H2O=[Cu(NH3)4]2+ + 2OH- + 4H2O 正八面体 m
Cu(OH)2+4NH3·H2O=[Cu(NH3)4]2+ + 2OH- + 4H2O 正八面体 m ![]() 或68% 12 面心立方最密堆积
或68% 12 面心立方最密堆积
【解析】
A为H,R为He,B为Li,C为C,D为N,E为O,F为F,T为Ne,G为Na,H为Mg,I为Al,J为Si,K为S,L为Cl,M为Cr,N为Fe,O为Cu。
(1)Fe的单质和水蒸气反应能生成固体Fe3O4,则Al与Fe3O4反应生成Fe和Al2O3,其化学方程式8Al+3Fe3O4 ![]() 4Al2O3+9Fe;故答案为:8Al+3Fe3O4
4Al2O3+9Fe;故答案为:8Al+3Fe3O4 ![]() 4Al2O3+9Fe。
4Al2O3+9Fe。
(2)D的气态氢化物NH3的价层电子对数为![]() ,VSEPR模型的名称为四面体形;故答案为:四面体形。
,VSEPR模型的名称为四面体形;故答案为:四面体形。
(3)由A、C、D形成的ACD分子HCN,其结构为H—C≡N,σ键和π键个数比为1:1;故答案为:1:1。
(4)要证明太阳上是否含有He元素,可采用的方法是对太阳光进行光谱分析;故答案为:对太阳光进行光谱分析。
(5)①ME2L2常温下为深红色液体,能与CCl4、CS2等互溶,CCl4、CS2是非极性分子,根据相似相溶原理得出ME2L2是非极性分子;故答案为:非极性。
②将N和O的单质用导线连接后插入D的最高价氧化物对应的水化物浓溶液中,可制成Cu—Al—浓硝酸原电池,则组成负极材料是铜,其外围电子轨道表示式为![]() ;故答案为:
;故答案为:![]() 。
。
(6)往Cu2+溶液中加入氨水,形成蓝色沉淀,继续加入氨水,难溶物溶解变成蓝色透明溶液,发生的是氢氧化铜和氨水反应生成四氨合铜子、氢氧根和水,其沉淀溶解的离子方程式Cu(OH)2+4NH3·H2O=[Cu(NH3)4]2+ + 2OH- + 4H2O;故答案为:Cu(OH)2+ 4NH3·H2O = [Cu(NH3)4]2+ + 2OH- + 4H2O。
(7)若F、K两种元素形成的化合物中中心原子的价电子全部参与成键则形成SF6,则该化合物的空间构型的名称为正八面体;故答案为:正八面体。
(8)如图四条折线分别表示ⅣA族、ⅤA族、ⅥA族、ⅦA族元素气态氢化物沸点变化,沸点最高的是H2O,因此m为H2O,n为HF,x为NH3,y为CH4,则E的氢化物为H2O,其所在的折线是m;故答案为:m。
(9)在1183 K以下的晶体中,则该晶体为体心立方,设原子半径为r,根据体对角线为4r,则晶胞参数为![]() ,则空间利用率为
,则空间利用率为 ;在1183 K以上的晶体中,晶体堆积方式为面心立方最密堆积,与N原子等距离且最近的N原子数为12;故答案为:
;在1183 K以上的晶体中,晶体堆积方式为面心立方最密堆积,与N原子等距离且最近的N原子数为12;故答案为:![]() 或68%;12;面心立方最密堆积。
或68%;12;面心立方最密堆积。

 阅读快车系列答案
阅读快车系列答案