题目内容
下图表示2A(g)+B(g) 2C(g) ΔH<0,这个反应的正确图像为( )
2C(g) ΔH<0,这个反应的正确图像为( )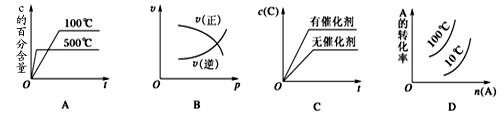
A
解析试题分析:A、温度高,反应速率加快,先到达平衡;升高温度,平衡向吸热方向移动,即向逆反应方向移动,C的体积分数降低,故A正确;B、压强增大,正逆反应速率都增大,故B错误;C、使用催化剂,加快反应,到达平衡的时间短,但不影响平衡的移动,平衡时C的浓度不变,故C错误;D、增大压强反应向体积减小方向移动,即向正反应方向移动,A的转化率增大;升高温度,平衡向吸热方向移动,即向逆反应方向移动,A的转化率降低,故D错误;故选A.
考点:本题考查化学平衡的移动与化学平衡图象

pH值相同的盐酸溶液和醋酸溶液分别和锌反应,若最后锌都已完全溶解,放出的氢气一样多,则下列判断正确的是( )
| A.整个反应阶段平均速率:醋酸>盐酸 | B.反应所需时间:醋酸>盐酸 |
| C.参加反应的锌的质量:盐酸<醋酸 | D.开始反应速率:盐酸>醋酸 |
一定条件下,将NO2与SO2以2∶3的体积比置于密闭容器中发生上反应:NO2(g)+SO2(g) SO3(g)+NO(g),测得上述反应平衡时NO2与SO2体积比为1∶4,则平衡时SO2(g)的转化率是( )
SO3(g)+NO(g),测得上述反应平衡时NO2与SO2体积比为1∶4,则平衡时SO2(g)的转化率是( )
| A.5/6 | B.3/4 | C.5/9 | D.2/3 |
已知反应2CO(g)===2C(s)+O2(g)的ΔH为正值,ΔS为负值。设ΔH和ΔS不随温度而变,下列说法正确的是
| A.低温下能自发进行 |
| B.高温下能自发进行 |
| C.低温下不能自发进行,高温下能自发进行 |
| D.任何温度下都不能自发进行 |
一定条件下,体积为10L的密闭容器中,1molX和1molY进行反应:2X(g)+Y(g)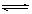 Z(g),经60s达到平衡,生成0.3molZ。下列说法正确的是
Z(g),经60s达到平衡,生成0.3molZ。下列说法正确的是
| A.以X浓度变化表示的反应速率为0.001mol/(L·s) |
B.将容器体积变为20L,Z的平衡浓度变为原来的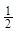 |
| C.若增大压强,则物质Y的转化率减小 |
| D.若升高温度,X的体积分数增大,则该反应的△H>0 |
已知某可逆反应:mA(g)+nB(g)  pC(g) △H=Q kJ·mol-1,在密闭容器中进行,下图表示在不同时间t、温度T、压强P与反应物B的百分含量的关系曲线,下列判断正确的是
pC(g) △H=Q kJ·mol-1,在密闭容器中进行,下图表示在不同时间t、温度T、压强P与反应物B的百分含量的关系曲线,下列判断正确的是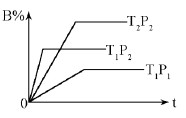
| A.T2>T1P1> P2 m+n > p Δ Η<0 |
| B.T1>T2P1< P2 m+n < p Δ Η>0 |
| C.T1<T2P1< P2 m+n < p Δ Η<0 |
| D.T1 >T2P1< P2 m+n > p Δ Η>0 |
一定条件下,向密闭容器中充入1 mol N2和3mol H2,发生反应:N2(g) + 3H2(g) 2NH3(g),反应达到平衡后,改变下述条件,再次达到平衡,NH3浓度与原平衡不同的是
2NH3(g),反应达到平衡后,改变下述条件,再次达到平衡,NH3浓度与原平衡不同的是
| A.保持温度和压强不变,充入1 mol NH3(g) |
| B.保持温度和体积不变,充入1 mol Ar(g) |
| C.保持温度和压强不变,充入1 mol N2(g) 和3mol H2 (g) |
| D.保持温度和压强不变,充入1 mol Ar(g) |
制取水煤气的反应为C(s)+H2O(g)  CO(g)+H2(g) ΔH>0;在一定条件下达化学平衡后,在时间为t时突然改变条件,反应速率的变化如图所示,在t时所改变的条件是
CO(g)+H2(g) ΔH>0;在一定条件下达化学平衡后,在时间为t时突然改变条件,反应速率的变化如图所示,在t时所改变的条件是
| A.加压 | B.升温 | C.增大水蒸气浓度 | D.增大碳的物质的量 |
下列说法正确的是
| A.放热反应一定都是自发的 |
| B.电解池的反应属于自发过程 |
| C.反应能否自发进行与温度有关 |
| D.能自发进行的化学反应,一定是△H>0、△S>0 |