题目内容
13.银锌电池是一种高能电池,它以KOH溶液为电解质溶液,发生的电池总反应为Ag2O+Zn═ZnO+2Ag,请回答下列问题:(1)负极的电极反应式是Zn+2OH--2e-=ZnO+H2O,正极的电极反应是为Ag2O+H2O+2e-=2Ag+2OH-;
(2)电池工作时,负极附近溶液的pH降低(填“升高”或“降低,下同”),正极附近溶液的pH升高.
分析 银锌电池中负极锌失电子,电极反应式:Zn+2OH--2e-=ZnO+H2O,正极氧化银得电子,则正极的电极方程式为Ag2O+H2O+2e-=2Ag+2OH-,结合电极方程式判断pH的变化.
解答 解:(1)发生的电池总反应为Ag2O+Zn═ZnO+2Ag,可知反应中Zn被氧化,应为原电池的负极,银锌电池中负极锌失电子,电极反应式:Zn+2OH--2e-=ZnO+H2O,Ag元素化合价降低,被还原,为正极反应,正极氧化银得电子,电极方程式为Ag2O+H2O+2e-=2Ag+2OH-,
故答案为:Zn+2OH--2e-=ZnO+H2O;Ag2O+H2O+2e-=2Ag+2OH-;
(2)负极消耗OH-,则pH降低,正极生成OH-,则pH升高,故答案为:降低;升高.
点评 本题考查了化学电源新型电池,为高频考点,侧重于学生的分析能力的考查,明确原电池原理是解答本题关键,再结合电极反应式解答,注意电极反应式的书写,难度中等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
4.要除去混在CO2气体中少量CO,最好的方法是( )
| A. | 点燃 | B. | 通氧气并点燃 | C. | NaOH溶液 | D. | 过灼热的氧化铜 |
5.草酸镍晶体(NiC2O4•2H2O)可用于制镍催化剂.某小组用废镍催化剂(成分为Al2O3、Ni、Fe、SiO2等)制备草酸镍晶体的部分实验流程如图1:

已知:①相关金属离子生成氢氧化物沉淀的pH如下表(开始沉淀的pH按金属离子浓度为1.0mol•L-1计算):
(1)粉碎的目的是增大接触面积,加快反应速率,提高镍的浸出率.
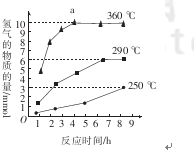
(2)保持其他条件相同,在不同温度下对废镍催化剂进行“酸浸”,镍浸出率随时间变化如图2.“酸浸”的适宜温度与时间分别为C(填字母)
a.30℃、30min b.90℃、150min
c.70℃、120min d.90℃、120min
(3)由流程中的“浸出液”得到“溶液x”,首先是加适量H2SO4溶液,再加足量H2SO4溶液,充分反应后用NaOH溶液调节pH5.0≤pH<6.7(填范围),充分反应后过滤,以除去铁、铝元素;
(4)将“沉镍”工序得到的混合物过滤,所得固体用乙醇洗涤、110℃下烘干按,得草酸镍晶体.
①用乙醇洗涤的目的是洗去(NH4)2SO4杂质、便于烘干,减少产品损失;
②烘干温度不超过110℃的原因是防止温度过高,草酸镍晶体分解或失去结晶水.

已知:①相关金属离子生成氢氧化物沉淀的pH如下表(开始沉淀的pH按金属离子浓度为1.0mol•L-1计算):
| 金属离子 | 开始沉淀的pH | 沉淀完全的pH |
| Fe3+ | 1.1 | 3.2 |
| Fe2+ | 5.8 | 8.8 |
| Al3+ | 3.0 | 5.0 |
| Ni2+ | 6.7 | 9.5 |
(2)保持其他条件相同,在不同温度下对废镍催化剂进行“酸浸”,镍浸出率随时间变化如图2.“酸浸”的适宜温度与时间分别为C(填字母)
a.30℃、30min b.90℃、150min
c.70℃、120min d.90℃、120min
(3)由流程中的“浸出液”得到“溶液x”,首先是加适量H2SO4溶液,再加足量H2SO4溶液,充分反应后用NaOH溶液调节pH5.0≤pH<6.7(填范围),充分反应后过滤,以除去铁、铝元素;
(4)将“沉镍”工序得到的混合物过滤,所得固体用乙醇洗涤、110℃下烘干按,得草酸镍晶体.
①用乙醇洗涤的目的是洗去(NH4)2SO4杂质、便于烘干,减少产品损失;
②烘干温度不超过110℃的原因是防止温度过高,草酸镍晶体分解或失去结晶水.
9.下列化学用语的书写,正确的是( )
| A. | NH4Br的电子式: | B. | S2-的结构示意图: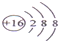 | ||
| C. | 氮气的结构式:N═N | D. | 乙烷的分子式:CH3CH3 |
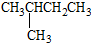
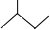
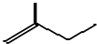 C5H10
C5H10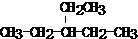
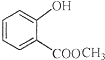 中含有的官能团的名称为羟基、酯基.
中含有的官能团的名称为羟基、酯基. ,氧元素在周期中的位置是第二周期第ⅥA族
,氧元素在周期中的位置是第二周期第ⅥA族