题目内容
【题目】Ⅰ.如图所示,甲、乙之间的隔板K和活塞F都可左右移动,甲中充入2molA和1molB,乙中充入2molC和1molHe,此时K停在0处。在一定条件下发生可逆反应:2A(g)+B(g)![]() 2C(g);反应达到平衡后,再恢复至原温度。回答下列问题:
2C(g);反应达到平衡后,再恢复至原温度。回答下列问题:
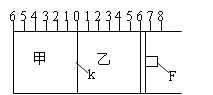
(1)可根据 _______________现象来判断甲乙都已达到平衡状态。
(2)达到平衡时,隔板K最终停留在0刻度左侧a处,则a的取值范围是___________________。
(3)若达到平衡时,隔板K最终停留在左侧刻度1处,此时甲容积为2L,反应化学平衡常数为______________(带单位)
Ⅱ.若一开始就将K、F如图固定,其他条件均不变,则达到平衡时:
(1)测得甲中A的转化率为b,则乙中C的转化率为 _________________ ;
(2)假设乙、甲两容器中的压强比用d表示,则d的取值范围是 ____________________ 。
【答案】 活塞K和F不在移动 0<a<2 4L/moL 1-b 4/3<d<3/2
【解析】试题分析:本题考查化学平衡的计算,极限法的使用,化学平衡的标志,恒温恒容下的等效平衡规律。
I(1)甲、乙之间的隔板K和活塞F都可左右移动,说明甲乙都是恒压容器。反应2A(g)+B(g)![]() 2C(g)是正反应为气体分子数减小的反应,建立平衡的过程中气体物质的量发生变化,气体体积发生变化,隔板K和活塞F发生移动,平衡时气体物质的量不变,隔板K和活塞F不再移动。根据隔板K和活塞F不再移动判断甲乙都已经达到平衡状态。
2C(g)是正反应为气体分子数减小的反应,建立平衡的过程中气体物质的量发生变化,气体体积发生变化,隔板K和活塞F发生移动,平衡时气体物质的量不变,隔板K和活塞F不再移动。根据隔板K和活塞F不再移动判断甲乙都已经达到平衡状态。
(2)用极限法,若甲中A和B不反应,隔板K停留在0刻度;若甲中A和B完全反应则生成2molC,根据恒温恒压下气体体积之比等于气体物质的量之比,(2mol+1mol):2mol=6:V,V=4,则隔板K停留在0刻度左侧2处;由于是可逆反应则a的取值范围2![]() a
a![]() 0。
0。
(3)若达到平衡时,隔板K最终停留在左侧刻度1处,设开始到平衡过程中转化的B的物质的量为x,用三段式
2A(g)+B(g)![]() 2C(g)
2C(g)
n(起始)(mol) 2 1 0
n(转化)(mol) 2x x 2x
n(平衡)(mol) 2-2x 1-x 2x
根据恒温恒压下气体的体积之比等于气体物质的量之比列式3:(2-2x+1-x+2x)=6:5,解得x=0.5mol,则平衡时A、B、C的物质的量依次为1mol、0.5mol、1mol,容积为2L,平衡时A、B、C的物质的量浓度依次为0.5mol/L、0.25mol/L、0.5mol/L,化学平衡常数=c2(C)/[c2(A)·c(B)]=(0.5mol/L)2/[(0.5mol/L)2![]() 0.25mol/L]=4L/mol。
0.25mol/L]=4L/mol。
II若一开始就将K、F如图固定,起始甲乙中气体物质的量都是3mol,则甲乙是恒温恒容且体积相等的容器。
(1)乙中平衡的建立可理解成:先在与甲等体积的乙容器中加入2molC达到平衡,维持温度容积不变再充入1molHe。乙中加入2molC,采用一边倒极限换算后为2molA和1molB,在恒温恒容时甲中加入2molA和1molB与乙中加入2molC达到平衡时互为完全全等的等效平衡,测得甲中A的转化率为b,则乙中C的转化率为1-b;乙恒温恒容平衡后再加入1molHe,由于各物质的浓度没有发生变化,化学平衡不移动,乙中C的转化率仍为1-b。答案为:1-b。
(2)在恒温恒容容器中压强之比等于气体物质的量之比。用极限法,若甲中A和B没有反应,甲中气体总物质的量为3mol,乙和甲互为等效平衡,则乙中气体总物质的量为3mol+1mol(1mol为He)=4mol,此时乙、甲中的压强比d=4/3;若甲中A和B完全反应,平衡时甲中气体总物质的量为2mol,乙和甲互为等效平衡,则乙中气体总物质的量为2mol+1mol(1mol为He)=3mol,此时乙、甲中的压强比d=3/2;则乙、甲两容器中的压强比d的取值范围是4/3<d<3/2。

 同步奥数系列答案
同步奥数系列答案