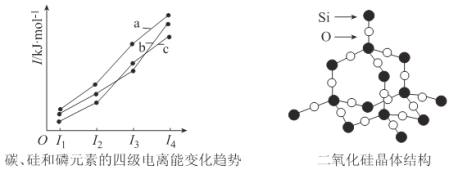
题目内容
【题目】已知乙酸(HA)的酸性比甲酸(HB)弱,在物质的量浓度均为0.1mol/L的NaA和NaB混合溶液中,下列排序正确的是( )
A. c(OH-)>c(HA)>c(HB)>c(H+) B. c(OH-)>c(A-)>c(B-)>c(H+)
C. c(OH-)>c(B-)>c(A-)>c(H+) D. c(OH-)>c(HB)>c(HA)>c(H+)
【答案】A
【解析】常温下0.1mol/L HA和0.1mol/L HB的pH均大于2,所以两者均为弱酸。在溶液中存在如下3个平衡,A-+H2O![]() HA+OH-、B-+H2O
HA+OH-、B-+H2O![]() HB+OH- 、H2O
HB+OH- 、H2O![]() H++OH-,水电离的氢离子大部分被 A-和B-结合,促进了水的电离使溶液呈碱性,在3个平衡体系中都生成氢氧根。因为HA的酸性比HB弱,所以在物质的量浓度均为0.1mol/L的NaA和NaB混合溶液中,A-的水解程度比B-的大,所以c(OH-)>c(HA)>c(HB)>c(H+), A正确。
H++OH-,水电离的氢离子大部分被 A-和B-结合,促进了水的电离使溶液呈碱性,在3个平衡体系中都生成氢氧根。因为HA的酸性比HB弱,所以在物质的量浓度均为0.1mol/L的NaA和NaB混合溶液中,A-的水解程度比B-的大,所以c(OH-)>c(HA)>c(HB)>c(H+), A正确。

【题目】已知:实验室常用无水乙醇(CH3CH2OH)制备乙烯,制备原理为:
CH3CH2OH![]() CH2=CH2↑+H2O。
CH2=CH2↑+H2O。
无水乙醇性质如下表:
物质 | 熔点/℃ | 沸点/℃ | 溶解性 | 挥发性 | 化学性质 |
无水乙醇 | —114.1 | 78.3 | 能与水以任意比互溶 | 易挥发 | 能使酸性高锰酸钾溶液褪色 |
甲、乙同学用下列实验装置制备乙烯并验证其性质。(气密性已检验,部分夹持装置略)。

实验操作和现象:
操 作 | 现 象 |
点燃酒精灯,加热至170℃ | I:A中烧瓶内液体渐渐变黑 II:B内气泡连续冒出,溶液逐渐褪色 |
…… | |
实验完毕,清洗烧瓶 | III:A中烧瓶内附着少量黑色颗粒状物,有刺激性气味逸出 |
(1)写出乙烯的1个用途: ,对应方程式为(注明反应类型) 。
(2)A中烧瓶内溶液“渐渐变黑”,说明浓硫酸具有 性。
(3)分析使B中溶液褪色的物质,甲认为是C2H4使B中溶液褪色,该反应的化学方程式为(注明反应类型) 。
(4)乙根据反应原理及现象I和III综合分析,认为产物中除乙烯外还混有乙醇、H2O、CO2和一种 “有刺激性气味”的气体X。你认为这种“有刺激性气味”气体X是 (填化学式)。
为验证气体X的存在,并证实是C2H4使B中溶液褪色,乙设计如下装置,与A连接:
设 计 | 现 象 |
与A连接的装置如下:
| C中溶液褪色,加热后又恢复红色; F中溶液褪色 |
请回答下列问题:
D中盛放的试剂是 (填化学式),不能盛放酸性KMnO4溶液的原因是(用离子方程式解释): 。