题目内容
【题目】合理利用资源,加强环境保护,降低碳排放,实施低碳经济是今后经济生活主流。回答下列问题:
(1)下列措施不利于有效减少二氧化碳的是______(填字母)。
a.植树造林,保护森林,保护植被
b.加大对煤和石油的开采,并鼓励使用液化石油气
c.大力发展风能、水力、潮汐能发电和核电,大力推行太阳能的综合开发
d.推广使用节能灯和节能电器,使用空调时夏季温度不宜设置过低,冬天不宜过高
(2)科学家致力于二氧化碳的“组合转化”技术研究,如将CO2和H2以1∶4的物质的量之比混合通入反应器,在适当条件下反应可获得一种重要能源。请完成以下化学方程式:CO2+4H2![]() _____+2H2O。
_____+2H2O。
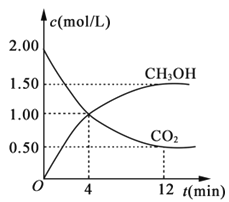
(3)用CO2合成燃料甲醇(CH3OH)是碳减排的新方向。现进行如下实验:某温度下在体积为1L的密闭容器中,充入2molCO2和6molH2,发生反应:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)。现测得CO2和CH3OH(g)的浓度随时间变化如图所示。从反应开始到平衡,氢气的平均反应速率v(H2)=___。
CH3OH(g)+H2O(g)。现测得CO2和CH3OH(g)的浓度随时间变化如图所示。从反应开始到平衡,氢气的平均反应速率v(H2)=___。
(4)以KOH为电解质的甲醇燃料电池总反应为2CH3OH+3O2+4KOH=2K2CO3+6H2O。通入甲醇的电极为燃料电池的______(填“正”或“负”)极,正极反应式为_______。
【答案】b CH4 0.375mol·L-1·min-1 负 O2+2H2O+4e-=4OH-
【解析】
(1)a.植树造林,保护森林,保护植被,能增强光合作用,大量消耗二氧化碳,a不符合题意;
b.加大对煤和石油的开采,并鼓励使用石油液化气,能增加二氧化碳的排放,b符合题意;
c.积极推进核能、风能、潮汐能建设,大力推行太阳能的综合开发能减少二氧化碳的排放,c不符合题意;
d.推广使用节能灯和节能电器,使用空调时夏季温度不宜设置过低,冬天不宜过高,能减少电的使用,减少煤和石油化石燃料的使用,减少二氧化碳的排放,d不符合题意;
故合理选项是b;
(2)根据质量守恒定律可知:反应前后各种元素的原子数目和种类不变,分析题给的化学反应方程式可以知道,反应物中有2个O,1个C,8个H,反应后出现了2个O,4个H,则在X中含有4个H和1个C,因此X化学式是CH4;
(3)由图可知,12min到达平衡时二氧化碳的浓度变化量△c(CO2)=2mol/L-0.5mol/L=1.5mol/L,所以v(CO2)=![]() =
=![]() =0.125mol/(Lmin),在同一时间段内用不同物质表示的化学反应速率之比等于化学方程式中相应物质的化学计量数之比,所以v(H2)=3v(CO2)=3×0.125mol/(Lmin)=0.375mol/(Lmin);
=0.125mol/(Lmin),在同一时间段内用不同物质表示的化学反应速率之比等于化学方程式中相应物质的化学计量数之比,所以v(H2)=3v(CO2)=3×0.125mol/(Lmin)=0.375mol/(Lmin);
(4)甲醇-空气燃料电池中,通入燃料甲醇的电极为负极,甲醇在负极失电子发生氧化反应,在碱溶液中生成碳酸盐,氧气在正极得到电子发生还原反应,电极反应为:O2+2H2O+4e-=4OH-。

 阅读快车系列答案
阅读快车系列答案【题目】表是25℃时某些弱酸的电离平衡常数,下列说法正确的是( )
化学式 | CH3COOH | HClO | H2CO3 |
Ka | 1.8×10﹣5 | 3.0×10﹣8 | Ka1=4.1×10﹣7 Ka2=5.6×10﹣11 |
A. 相同浓度CH3COONa和NaClO的混合液中,各离子浓度的大小关系是:c(Na+)>c(ClO﹣)>c(CH3COO﹣)>c(OH﹣)>c(H+)
B. 向0.1mol·L﹣1CH3COOH溶液中滴加NaOH溶液至溶液pH=5,此时溶液中c(CH3COOH):c(CH3COO﹣)=9:5
C. 少量碳酸氢钠固体加入到新制的氯水中,c(HClO)增大
D. 等体积等物质的量浓度的CH3COONa(aq)与NaClO(aq)中离子总数大小:N前<N后
【题目】目前世界上广泛采用氨和二氧化碳高温高压下制备尿素,主要反应为两步:
第一步:生成氨基甲酸铵 | 第二步:氨基甲酸铵脱水生成尿素 |
2NH3(l)+CO2(g) | H2NCOONH4(l)
|
快速放热 | 慢速吸热 |
(1)写出制备尿素的总反应化学方程式:____________________________,该反应热为![]() ,则
,则![]() ______________(“大于”“小于”或“等于”)
______________(“大于”“小于”或“等于”)![]() 。
。
(2)下列说法正确的是________________。
A.利用二氧化碳制备尿素是减缓温室效应的有效方法
B.第二步反应高温条件下自发进行
C.提高投料中的水碳比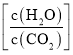 有利于尿素的生成
有利于尿素的生成
D.第一步反应的活化能大于第二步反应
(3)尿素生产过程中转化率通常用二氧化碳转化率来表示,当二氧化碳起始浓度为![]() 时(
时(![]() ,水碳比=0.5),尿素平衡转化率随氨碳比
,水碳比=0.5),尿素平衡转化率随氨碳比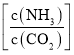 的变化如表所示:
的变化如表所示:
氨碳比/浓度比 | 2.95 | 3.10 | 3.20 | 3.50 |
尿素平衡转化率/% | 56.4 | 57.5 | 57.9 | 60.0 |
提高氨碳比有利于生成尿素,主要有两个原因:一是增大氨气浓度有利于反应正向移动;二是_____________。氨碳比为3.50时,求该状态下的制备尿素总反应平衡常数K=___________.
(4)一定条件下,在图中绘制氨基甲酸铵(![]() )在反应过程中物质的量与时间的关系图。
)在反应过程中物质的量与时间的关系图。
 _______________
_______________
(5)通过直接尿素燃料电池装置,实现了“尿素能”的利用,且产生无污染的产物,写出负极反应:____________________________.

【题目】某学生用0.10 mol/L标准NaOH溶液滴定某浓度的盐酸。记录数据如下:
实验编号 | NaOH溶液的浓度(mol/L) | 消耗NaOH溶液的体积(mL) | 待测盐酸溶液的体积(mL) |
1 | 0.10 | 19.98 | 20.00 |
2 | 0.10 | 20.02 | 20.00 |
3 | 0.10 | 20.00 | 20.00 |
(1)滴定时可用的指示剂是__________________。
A.品红溶液 B.酚酞试液 C.石蕊试液
(2)排去碱式滴定管中气泡的方法应采用操作_________,然后轻轻挤压玻璃球使尖嘴部分充满碱液。

(3)滴定操作时,眼睛应注视____________________________________________。
(4)滴定达到终点的现象____________________________________________________。
(5)碱式滴定管尖嘴部分有气泡,滴定后消失,对测定结果的影响是_______(填“偏高”或“偏低”或“不影响”,下同);碱式滴定管滴定前仰视滴定后俯视,对测定结果的影响是_______;锥形瓶用水洗净后没用酸润洗,结果会________。
(6)根据上述数据,计算出该盐酸的浓度约为__________________(保留两位有效数字)。