题目内容
【题目】下列图示与对应的叙述不相符的是




图1 图2 图3 图4
A. 图1表示KNO3的溶解度曲线,图中a点所示的溶液是80℃时KNO3的不饱和溶液
B. 图2表示某放热反应分别在有、无催化剂的情况下反应过程中的能量变化
C. 图3表示0.1000molL-1NaOH溶液滴定20.00mL0.1000molL-1醋酸溶液得到的滴定曲线
D. 图4 表示向NH4Al(SO4)2溶液中逐滴滴入Ba(OH)2溶液,随着Ba(OH)2溶液体积V的变化,沉淀总物质的量n的变化
【答案】C
【解析】试题分析:A、KNO3的溶解度随着温度的升高而升高,溶解度曲线上的点是饱和溶液,曲线以下的a点是不饱和溶液,A正确;B、反应物的总能量大于生成物的总能量,则反应是放热反应,加入催化剂会降低活化能,改变反应的速率,但反应热不改变,B正确;C、0.1000molL-1NaOH溶液滴定20.00mL 0.1000molL-1CH3COOH溶液,消氢氧化钠溶液体积为0时,醋酸为弱电解质,醋酸溶液的pH大于1,图象中醋酸的pH=1与实际不符,C错误;D、开始滴加同时发生反应为Al3++3OH-=Al(OH)3↓,当Al3+沉淀完全时铵根开始结合氢氧根生成一水合氨。当铵根完全反应后,生成的氢氧化铝开始溶解在氢氧化钠中,沉淀减少,图像符合,D正确,答案选C。

 愉快的寒假南京出版社系列答案
愉快的寒假南京出版社系列答案【题目】在T℃时,发生反应C(s)+H2O(g) ![]() CO(g)+H2(g)。
CO(g)+H2(g)。
(1)T℃时,在一个2L的密闭容器中加入4molC和1molH2O(g),5min后反应达到平衡,C的转化率为20%。
①0~5min内,用H2O(g)表示的平均反应速率为____________。
②该反应达到平衡的标志是______。
a.气体的平均相对分子质量不变
b.气体的密度不变
c.H2O(g)、CO(g)、H2(g)的物质的量之比为1:1:1
d.气体的总物质的量不变
(2)T℃时,在下列密闭容器中加入相应的物质进行实验,中间的隔板可以自由滑动。

①若左室中气体的平均相对分子质量一直保持不变,则反应开始前H2O(g)、H2(g)的物质的量之比是__________。
②反应在达到平衡时,中间的隔板所处的位置是________。
a.1~1.5之间 b.1.5处 c.1.5~2之间
(3)已知:I.破坏1mol共价键所需要的能量如下表:
共价键 | 石墨中的碳碳键 | H-H | C≡O | H-O |
能量/kJ | 475.7 | 436 | 1072 | 463 |
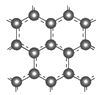
Ⅱ.石墨层由六角形蜂巢结构的碳原子构成,如图所示:
某同学构想:通过下列装置实现C(s)+H2O(g) ![]() CO(g)+H2(g)的反应。
CO(g)+H2(g)的反应。
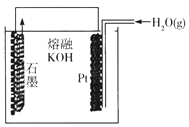
①按该考生的构想,石墨电极发生的反应式为_______________。
②这个构想成立吗?说明理由: _______________。