题目内容
【题目】图为周期表的一部分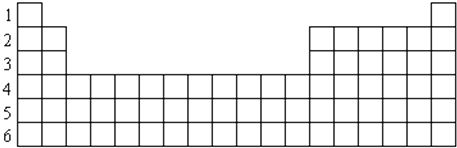
(1)请将原子序数为1、6、10、12、13、17、37八种元素的元素符号填在相应的空格内.
(2)第17号元素的名称是 , 该元素在周期表中的位置是 , 该元素的原子结构示意图为 .
(3)上述元素中化学性质最稳定的是 .
(4)上述元素中能以离子键结合成AB2型的化合物有 , 用电子式表示其形成过程 .
(5)上述元素的最高价氧化物所对应的水化物中,酸性最强的化合物是 , 碱性最强的化合物是 , 具有两性的氢氧化物是 .
【答案】
(1)
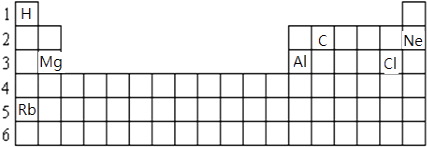
(2)氯;第三周期第ⅤⅡA族;![]()
(3)Ne
(4)MgCl2;![]()
(5)HClO4;RbOH;Al(OH)3
【解析】解:(1)原子序数为1、6、10、12、13、17、37分别为H、C、Ne、Mg、Al、Cl、Rb,在元素周期表的位置如图  ,
,
所以答案是:  ;
;
(2.)第17号元素为Cl,名称为氯,位于第三周期第ⅤⅡA族,该元素的原子结构示意图为 ![]() ,所以答案是:氯;第三周期第ⅤⅡA族;
,所以答案是:氯;第三周期第ⅤⅡA族; ![]() ;
;
(3.)Ne的最外层为8电子稳定结构,上述元素中化学性质最稳定的是Ne,所以答案是:Ne;
(4.)上述元素中能以离子键结合成AB2型有MgCl2 , 用电子式表示其形成过程为 ![]() ,所以答案是:MgCl2;
,所以答案是:MgCl2; ![]() ;
;
(5.)上述元素的最高价氧化物所对应的水化物中,酸性最强的化合物是HClO4 , 碱性最强的化合物是RbOH,具有两性的氢氧化物是Al(OH)3 , 所以答案是:HClO4;RbOH;Al(OH)3 .

练习册系列答案
 优翼小帮手同步口算系列答案
优翼小帮手同步口算系列答案
相关题目