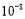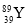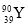ЬтФПФкШн
вЛЖЈЮТЖШЯТ2 LЕФКуШнШнЦїМзжа,МгШы2 molЬМКЭ2 mol CO2ЗЂЩњШчЯТЗДгІ: C(s)+CO2(g)  2CO(g)ЁЁІЄH>0,ВтЕУШнЦїжаCO2ЕФЮяжЪЕФСПЫцЪБМфtЕФБфЛЏЙиЯЕШчЭМЫљЪОЁЃ
2CO(g)ЁЁІЄH>0,ВтЕУШнЦїжаCO2ЕФЮяжЪЕФСПЫцЪБМфtЕФБфЛЏЙиЯЕШчЭМЫљЪОЁЃ
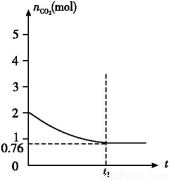
(1)ИУЗДгІЕФІЄSЁЁЁЁ0(ЬюЁА>ЁБЁЂЁА<ЁБЛђЁА=ЁБ)ЁЃдкЁЁЁЁЁЁЁЁ(ЬюЁАНЯИпЁБЛђЁАНЯЕЭЁБ)ЮТЖШЯТгаРћгкИУЗДгІздЗЂНјааЁЃ
(2)СаЪНВЂМЦЫуЩЯЪіЮТЖШЯТДЫЗДгІЕФЦНКтГЃЪ§ЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁ (НсЙћБЃСєвЛЮЛаЁЪ§)ЁЃ
(3)ЯђЩЯЪіЦНКтЬхЯЕжадйЭЈШыCO2,дђCO2ЕФзЊЛЏТЪЁЁЁЁЁЁЁЁ(ЬюЁАдіДѓЁБЁЂЁАМѕаЁЁБЁЂЁАВЛБфЁБЛђЁАЮоЗЈШЗЖЈЁБ)ЁЃ
(4)ЯрЭЌЮТЖШЯТ,2 LЕФКуШнШнЦїввжаМгШы4 molЬМКЭ4 mol CO2,ДяЕНЦНКтЁЃЧыдкЭМжаЛГіввШнЦїжаCO2ЕФЮяжЪЕФСПЫцЪБМфtБфЛЏЙиЯЕЕФдЄЦкНсЙћЪОвтЭМЁЃ(зЂУїЦНКтЪБCO2ЕФЮяжЪЕФСП)
(5)ЯрЭЌЮТЖШЯТ,2 LЕФКуШнШнЦїБћжаМгШы4 molЬМЁЂ4 mol CO2КЭ4 mol COЁЃПЊЪМЗДгІЪБvе§ЁЁЁЁЁЁЁЁ vФц(ЬюЁА>ЁБЁЂЁА<ЁБЛђЁА=ЁБ)ЁЃ
(1)>ЁЁНЯИпЁЁ
(2)K=c2(CO)/c(CO2)=1.242/0.38Ёж4.0
(3)МѕаЁ
(4)
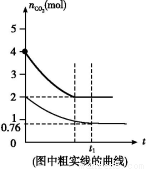
(5)>
ЁОНтЮіЁП(1)ИљОнЗНГЬЪНПЩжЊ,ИУЗДгІЪЧьижЕдіМгЕФ,гЩгкЗДгІЪЧЮќШШЗДгІ,ИљОнІЄG=ІЄH-TІЄS,вЊЪЙИУЗДгІздЗЂНјаа,ІЄG<0,дђашвЊдкИпЮТЯТЁЃ
(2)ЦНКтЪБCO2ЕФЮяжЪЕФСПЪЧ0.76 mol,дђЯћКФCO2ЪЧ(2-0.76) mol=1.24 mol,ЫљвдЩњГЩCOЪЧ2.48 mol,вђДЫCO2КЭCOЕФХЈЖШЗжБ№ЪЧ0.38 mol/LКЭ1.24 mol/L,ЫљвдK=c2(CO)/c(CO2)=1.242/0.38Ёж4.0ЁЃ
(3)діДѓCO2ЕФХЈЖШ,дђЦНКтЯђе§ЗДгІЗНЯђвЦЖЏ,ЕЋCO2ЕФзЊЛЏТЪНЕЕЭЁЃ
(4)гЩгкCO2ЕФХЈЖШдіДѓ,ЫљвдЗДгІЫйТЪМгПь,ДяЕНЦНКтЕФЪБМфМѕЩйЁЃЩшЯћКФCO2 x mol,дђЩњГЩCOЮЊ2x mol,ЫљвдгаK=c2(CO)/c(CO2)=x2/(2-0.5x)=4.0,НтЕУx=2 mol,ОнДЫПЩЛГіЪОвтЭМЁЃ
(5)гЩгкДЫЪБc2(CO)/c(CO2)=22/2=2<4.0,ЫљвдЗДгІЯђе§ЗДгІЗНЯђвЦЖЏ,дђе§ЗДгІЫйТЪДѓгкФцЗДгІЫйТЪЁЃ

 ЬьЬьЯђЩЯвЛБОКУОэЯЕСаД№АИ
ЬьЬьЯђЩЯвЛБОКУОэЯЕСаД№АИ аЁбЇЩњ10ЗжжггІгУЬтЯЕСаД№АИ
аЁбЇЩњ10ЗжжггІгУЬтЯЕСаД№АИ(1)вбжЊXЁЂYЁЂZЮЊЕкШ§жмЦкдЊЫи,ЦфдзгЕФЕквЛжСЕкЫФЕчРыФмШчЯТБэ:
ЕчРыФм/kJЁЄmol-1 | I1 | I2 | I3 | I4 |
X | 578 | 1 817 | 2 745 | 11 578 |
Y | 738 | 1 451 | 7 733 | 10 540 |
Z | 496 | 4 562 | 6 912 | 9 543 |
дђXЁЂYЁЂZЕФЕчИКадДгДѓЕНаЁЕФЫГађЮЊЁЁЁЁЁЁЁЁЁЁЁЁ(гУдЊЫиЗћКХБэЪО),дЊЫиYЕФЕквЛЕчРыФмДѓгкXЕФЕквЛЕчРыФмЕФдвђЪЧЁЁ
ЁЁЁЃ
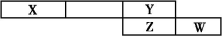
(2)AЁЂBЁЂCЁЂDЪЧжмЦкБэжаЧА10КХдЊЫи,ЫќУЧЕФдзгАыОЖвРДЮМѕаЁЁЃDФмЗжБ№гыAЁЂBЁЂCаЮГЩЕчзгзмЪ§ЯрЕШЕФЗжзгMЁЂNЁЂW,ЧвдкMЁЂNЁЂWЗжзгжа,AЁЂBЁЂCШ§дзгЖМВЩШЁsp3дгЛЏЁЃ
ЂйAЁЂBЁЂCЕФЕквЛЕчРыФмгЩаЁЕНДѓЕФЫГађЮЊЁЁЁЁЁЁЁЁЁЁЁЁ(гУдЊЫиЗћКХБэЪО)ЁЃ
ЂкMЪЧКЌгаЁЁЁЁЁЁЁЁМќЕФЁЁЁЁЁЁЁЁЗжзг(ЬюЁАМЋадЁБЛђЁАЗЧМЋадЁБ)ЁЃ
ЂлNЪЧвЛжжвзвКЛЏЕФЦјЬх,ЧыМђЪіЦфвзвКЛЏЕФдвђ:
ЁЁЁЃ
ЂмWЗжзгЕФVSEPRФЃаЭЕФПеМфЙЙаЭЮЊЁЁЁЁЁЁЁЁ,WЗжзгЕФПеМфЙЙаЭЮЊЁЁЁЁЁЁЁЁЁЃ
ЂнAB-жаКЭB2ЗжзгЕФІаМќЪ§ФПБШЮЊЁЁЁЁЁЁЁЁЁЃ
(3)EЁЂFЁЂGШ§дЊЫиЕФдзгађЪ§вРДЮдіДѓ,Ш§дзгЕФКЫЭтЕФзюЭтВуЕчзгХХВМОљЮЊ4s1ЁЃ
ЂйEдЊЫизщГЩЕФЕЅжЪЕФОЇЬхЖбЛ§ФЃаЭЮЊЁЁЁЁЁЁЁЁ(ЬюзжФИ)ЁЃ
a.МђЕЅСЂЗНЖбЛ§b.ЬхаФСЂЗНЖбЛ§ЁЁ
c.СљЗНзюУмЖбЛ§d.УцаФСЂЗНзюУмЖбЛ§
ЂкFдЊЫидкЦфЛЏКЯЮяжазюИпЛЏКЯМлЮЊЁЁЁЁЁЁЁЁЁЃ
ЂлG2+ЕФКЫЭтЕчзгХХВМЪНЮЊЁЁ ,G2+КЭNЗжзгаЮГЩЕФХфРызгЕФНсЙЙЪНЮЊЁЁЁЁЁЁЁЁЁЁЁЁЁЃ
25 ЁцЪБ,ЕчРыЦНКтГЃЪ§:
ШѕЫсЕФЛЏбЇЪН | CH3COOH | HClO | H2CO3 |
ЕчРыЦНКтГЃЪ§(25 Ёц) | 1.8ЁС10-5 | 3.0ЁС | K1=4.3ЁС10-7 K2=5.6ЁС10-11 |
ЛиД№ЯТСаЮЪЬт:
(1)ЮяжЪЕФСПХЈЖШЮЊ0.1 mol/LЕФЯТСаЫФжжЮяжЪ:
a.Na2CO3,b.NaClO,c.CH3COONa,d.NaHCO3;
pHгЩДѓЕНаЁЕФЫГађЪЧЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁ(ЬюБрКХ)ЁЃ
(2)ГЃЮТЯТ0.1 mol/LЕФCH3COOHШмвКМгЫЎЯЁЪЭЙ§ГЬжа,ЯТСаБэДяЪНЕФЪ§ОнвЛЖЈБфаЁЕФЪЧЁЁЁЁЁЁЁЁ;
A.c(H+) B.c(H+)/c(CH3COOH) C.c(H+)ЁЄc(OH-) D.c(OH-)/c(H+)
(3)ЬхЛ§ЮЊ10 mL pH=2ЕФДзЫсШмвКгывЛдЊЫсHXЗжБ№МгЫЎЯЁЪЭжС1 000 mL,ЯЁЪЭЙ§ГЬpHБфЛЏШчЭМ,дђHXЕФЕчРыЦНКтГЃЪ§ЁЁЁЁЁЁЁЁ(ЬюЁАДѓгкЁБЁЂЁАЕШгкЁБЛђЁАаЁгкЁБ)ДзЫсЕФЦНКтГЃЪ§;РэгЩЪЧЁЁ ЁЁ,
ЯЁЪЭКѓ,HXШмвКжаЫЎЕчРыГіРДЕФc(H+)ЁЁЁЁЁЁЁЁ(ЬюЁАДѓгкЁБЁЂЁАЕШгкЁБЛђЁАаЁгкЁБ)ДзЫсШмвКжаЫЎЕчРыГіРДЕФc(H+),РэгЩЪЧЁЁ ;
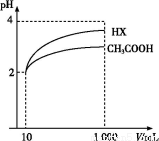
(4)25 ЁцЪБ,CH3COOHгыCH3COONaЕФЛьКЯШмвК,ШєВтЕУЛьКЯвКpH=6,дђШмвКжаc(CH3COO-)-c(Na+)=ЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁ(ЬюзМШЗЪ§жЕ)ЁЃ
ЫЎУКЦјЪЧвЛжжИпаЇЦјЬхШМСЯ,ЦфжївЊГЩЗжЪЧCOКЭH2,ПЩгУЫЎеєЦјЭЈЙ§ГуШШЕФЬМжЦЕУ:C (s)+H2O(g) CO (g)+H2 (g)ЁЁІЄH=+131 kJЁЄmol-1
CO (g)+H2 (g)ЁЁІЄH=+131 kJЁЄmol-1
(1)TЮТЖШЯТ,ЫФИіШнЦїжаОљНјаазХЩЯЪіЗДгІ,ИїШнЦїжаЬМзуСП,ЦфЫћЮяжЪЕФЮяжЪЕФСПХЈЖШМАе§ЁЂФцЗДгІЫйТЪЙиЯЕШчЯТБэЫљЪОЁЃЧыЬюаДБэжаЯргІЕФПеИёЁЃ
ШнЦї БрКХ | c(H2O) /molЁЄL-1 | c(CO) /molЁЄL-1 | c(H2) /molЁЄL-1 | vе§ЁЂvФцБШНЯ |
Ђё | 0.06 | 0.60 | 0.10 | vе§=vФц |
Ђђ | 0.06 | 0.50 | 0.40 | Ђй |
Ђѓ | 0.12 | 0.40 | 0.80 | vе§<vФц |
Ђє | 0.12 | 0.30 | Ђк | vе§=vФц |
ЂйЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁ,ЂкЁЁ ЁЃ
дкTЮТЖШЯТИУЗДгІЕФЛЏбЇЦНКтГЃЪ§ЮЊЁЁЁЁЁЁ ЁЁЁЃ
(2)СэгавЛИіШнЛ§ПЩБфЕФУмБеШнЦїЁЃКуЮТКубЙЯТ,ЯђЦфжаМгШы1.0 molЬМКЭ1.0 molЫЎеєЦј (H2O),ЗЂЩњЩЯЪіЗДгІ,ДяЕНЦНКтЪБ,ШнЦїЕФЬхЛ§БфЮЊдРДЕФ1.25 БЖЁЃЦНКтЪБЫЎеєЦјЕФзЊЛЏТЪЮЊЁЁЁЁЁЁЁЁ;ЯђИУШнЦїжаВЙГфa mol ЬМ,ЫЎеєЦјЕФзЊЛЏТЪНЋЁЁЁЁЁЁЁЁ (Ью ЁАдіДѓЁБЁЂЁАМѕаЁЁБЛђЁАВЛБфЁБ)ЁЃ
(3)дквЛЖЈЬѕМўЯТгУЫЎУКЦјФмКЯГЩМзДМ:CO(g)+2H2(g)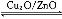 CH3OH(g)ЁЁІЄH>0,ИјКЯГЩМзДМЗДгІЬхЯЕжаЭЈШыЩйСПCOдђЦНКтЁЁЁЁЁЁЁЁ вЦЖЏ,МѕаЁбЙЧПдђЦНКтЁЁЁЁЁЁЁЁвЦЖЏ,НЕЕЭЮТЖШдђЦНКтЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁвЦЖЏ(ЬюЁАЯђзѓЁБЁЂЁАЯђгвЁБЛђЁАВЛЁБ)ЁЃ
CH3OH(g)ЁЁІЄH>0,ИјКЯГЩМзДМЗДгІЬхЯЕжаЭЈШыЩйСПCOдђЦНКтЁЁЁЁЁЁЁЁ вЦЖЏ,МѕаЁбЙЧПдђЦНКтЁЁЁЁЁЁЁЁвЦЖЏ,НЕЕЭЮТЖШдђЦНКтЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁвЦЖЏ(ЬюЁАЯђзѓЁБЁЂЁАЯђгвЁБЛђЁАВЛЁБ)ЁЃ