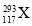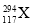题目内容
水煤气是一种高效气体燃料,其主要成分是CO和H2,可用水蒸气通过炽热的碳制得:C (s)+H2O(g) CO (g)+H2 (g) ΔH=+131 kJ·mol-1
CO (g)+H2 (g) ΔH=+131 kJ·mol-1
(1)T温度下,四个容器中均进行着上述反应,各容器中碳足量,其他物质的物质的量浓度及正、逆反应速率关系如下表所示。请填写表中相应的空格。
容器 编号 | c(H2O) /mol·L-1 | c(CO) /mol·L-1 | c(H2) /mol·L-1 | v正、v逆比较 |
Ⅰ | 0.06 | 0.60 | 0.10 | v正=v逆 |
Ⅱ | 0.06 | 0.50 | 0.40 | ① |
Ⅲ | 0.12 | 0.40 | 0.80 | v正<v逆 |
Ⅳ | 0.12 | 0.30 | ② | v正=v逆 |
① ,② 。
在T温度下该反应的化学平衡常数为 。
(2)另有一个容积可变的密闭容器。恒温恒压下,向其中加入1.0 mol碳和1.0 mol水蒸气 (H2O),发生上述反应,达到平衡时,容器的体积变为原来的1.25 倍。平衡时水蒸气的转化率为 ;向该容器中补充a mol 碳,水蒸气的转化率将 (填 “增大”、“减小”或“不变”)。
(3)在一定条件下用水煤气能合成甲醇:CO(g)+2H2(g)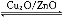 CH3OH(g) ΔH>0,给合成甲醇反应体系中通入少量CO则平衡 移动,减小压强则平衡 移动,降低温度则平衡 移动(填“向左”、“向右”或“不”)。
CH3OH(g) ΔH>0,给合成甲醇反应体系中通入少量CO则平衡 移动,减小压强则平衡 移动,降低温度则平衡 移动(填“向左”、“向右”或“不”)。
(1)①v正<v逆 ②0.40 1.00
(2)25% 不变 (3)向右 向左 向左
【解析】(1)根据Ⅰ可知,K=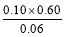 =1.00,Ⅱ中Q=
=1.00,Ⅱ中Q=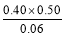 =
=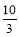 >K,所以反应向逆反应方向移动,即正反应速率小于逆反应速率。在Ⅳ中反应处于平衡状态,设c(H2)=a mol·L-1,则
>K,所以反应向逆反应方向移动,即正反应速率小于逆反应速率。在Ⅳ中反应处于平衡状态,设c(H2)=a mol·L-1,则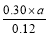 =1.00,解得a=0.40。
=1.00,解得a=0.40。
(2) C(s)+H2O(g) CO(g)+H2(g)
CO(g)+H2(g)
起始量(mol) 1.0
转化量(mol) x x x
平衡量(mol) 1.0-xx x
所以有1.0-x+x+x=1.25×1.0
解得x=0.25
所以转化率是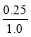 ×100%=25%
×100%=25%
碳是固体,所以增加碳的质量,平衡不移动,水蒸气的转化率不变。
(3)增加CO的浓度,平衡向正反应方向移动。因为反应是体积减小的、吸热的可逆反应,所以降低压强或降低温度平衡都向逆反应方向移动。

X、Y、Z、W为四种短周期主族元素,它们在周期表中的相对位置如图所示。Z元素原子核外K层与M层电子数相等。下列说法中正确的是( )
|
| X | Y |
Z | W |
|
|
A.Y元素最高价氧化物对应的水化物化学式为H3YO4
B.原子半径由小到大的顺序为:X<Z<Y<W
C.与同浓度的盐酸反应,Z比W更剧烈
D.X的氧化物不能与Z单质反应