题目内容
【题目】已知甲、乙、丙、 X 是4种中学化学中常见的物质,其转化关系符合下图(部分产物已略去)。下列说法中,正确的是
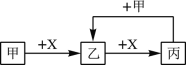
A. 若甲为单质铁,则丙一定为FeCl3
B. 若甲为强碱,则X一定为CO2
C. 若乙是一种白色胶状沉淀,则甲溶液中一定含有Al3+
D. 若甲为单质,则此关系中涉及的反应一定都是氧化还原反应
【答案】D
【解析】
A.若甲为单质铁,则X可以为硝酸等;B.若甲为强碱,则X可以为CO2、SO2、H2S等;C.乙是一种白色胶状沉淀,若甲为铝盐,X为强碱、乙为氢氧化铝、丙为偏铝酸盐;若甲为偏铝酸盐,X为强酸、丙为铝盐;D.若甲为单质,乙、丙中含有的甲元素化合价不同,均为氧化还原反应。
A.若甲为单质铁,则X不可能为FeCl3,铁与氯气反应只生成氯化铁;甲可以是硝酸等,丙为Fe(NO3)3等,选项A错误;B.若甲为强碱,则X可以为CO2、SO2、H2S等,选项B错误;C.乙是一种白色胶状沉淀,若甲为铝盐,X为强碱、乙为氢氧化铝、丙为偏铝酸盐;若甲为偏铝酸盐,X为强酸、丙为铝盐,选项C错误;D.若甲为单质,乙、丙中含有的甲元素化合价不同,均为氧化还原反应,选项D正确,答案选D。

【题目】Ni为第Ⅷ 族元素,在许多工业生产中都有涉及。
已知草酸镍晶体(NiC2O4·2H2O)难溶于水,工业上从废镍催化剂(成分主要为Ni,含有一定量的Al2O3、Fe、SiO2、CaO等)制备草酸镍晶体的流程如图所示:

已知:①相关金属离子生成氢氧化物沉淀的pH如下表:
金属离子 | Fe3+ | Fe2+ | Al3+ | Ni2+ |
开始沉淀的pH | 1.1 | 5.8 | 3.0 | 6.8 |
完全沉淀的pH | 3.2 | 8.8 | 5.0 | 9.5 |
②Ksp(CaF2)=1.46×10-10 ③当某物质浓度小于1.0×10-5 mol/L时,视为完全沉淀
(1)请写出一种能提高酸浸速率的措施________________。
(2)试剂a是一种绿色氧化剂,写出“氧化”时反应的离子方程式__________________________。
(3)pH的调控范围为 __________________,滤渣Ⅱ的成分为_____________________________。
(4)写出“沉镍”时反应的离子方程式___________________________________________,证明Ni2+已经沉淀完全的实验步骤及现象是______________________________________,当Ca2+沉淀完全时,溶液中c(F-)>_____________ mol/L(写出计算式即可)。
(5)操作a的内容是____________________________________________。


