题目内容
【题目】常温下向100mLFeCl3溶液中通入0.224L H2S,生成单质硫,再加入过量铁粉,反应停止后溶液中含有0.06mol阳离子。原FeCl3溶液的物质的量浓度是
A. 0.2 mol/L B. 0.3 mol/L C. 0.4 mol/L D. 0.6 mol/L
【答案】C
【解析】
该反应过程为:氯化铁和硫化氢反应生成氯化亚铁和盐酸、S,生成的盐酸再和铁反应生成氯化亚铁,所以最终溶液中的溶质是氯化亚铁,根据氯原子守恒计算氯化铁的物质的量浓度。
该反应过程为:氯化铁和硫化氢反应生成氯化亚铁和盐酸、S,生成的盐酸再和铁反应生成氯化亚铁,所以最终溶液中的溶质是氯化亚铁,根据氯原子守恒计算氯化铁的物质的量浓度,2n(FeCl3)=3n(FeCl2),n(FeCl3)=![]() n(FeCl2)=0.06mol×
n(FeCl2)=0.06mol×![]() =0.04mol,则原氯化铁溶液的浓度为:c(FeCl3)=
=0.04mol,则原氯化铁溶液的浓度为:c(FeCl3)=![]() =0.4mol/L,答案选C。
=0.4mol/L,答案选C。

 阅读快车系列答案
阅读快车系列答案【题目】氯气可用于制取漂白剂和自来水消毒。
(1)将氯气通入水中制得氯水,氯水可用于漂白,其中起漂白作用的物质是________(填写化学式)。
(2)“84”消毒液也可用于漂白,其工业制法是控制在常温条件下,将氯气通入NaOH溶液中,反应的离子方程式为______________________。
(3)同学们探究“84”消毒液在不同pH下使红纸褪色的情况,做了如下实验:
步骤1:将5 mL市售“84”消毒液稀释100倍,测得稀释后溶液的pH=12;
步骤2:将稀释后溶液各20 mL分别加入3个洁净的小烧杯中;
步骤3:用H2SO4溶液将3个烧杯内溶液的pH分别调至10、7和4。(溶液体积变化忽略不计)
步骤4:在3个烧杯中分别放入大小相同的红纸,观察现象,记录如下:
烧杯 | 溶液的pH | 现象 |
a | 10 | 10 min后,红纸基本不褪色;4 h后红纸褪色 |
b | 7 | 10 min后,红纸颜色变浅;4 h后红纸褪色 |
c | 4 | 10 min后,红纸颜色变得更浅;4 h后红纸褪色 |
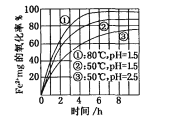
已知,溶液中Cl2、HClO和ClO-物质的量分数(α)随溶液pH变化的关系如下图所示:
![]()

①由实验现象可获得以下结论:溶液的pH在4~10范围内,pH越大,红纸褪色________。
②结合图像进行分析,b、c两烧杯中实验现象出现差异的原因是________。
(4)由于氯气会与自来水中的有机物发生反应生成对人体有害的物质,人们尝试研究并使用新的自来水消毒剂,如ClO2气体就是一种新型高效含氯消毒剂。
①一种制备ClO2的方法是用SO2通入硫酸酸化的NaClO3溶液中,反应的离子方程式为________。
②另一种制备ClO2的方法是用NaClO3与盐酸反应,同时有Cl2生成,产物中Cl2体积约占1/3,每生成0.5 mol ClO2,转移________mol e-。