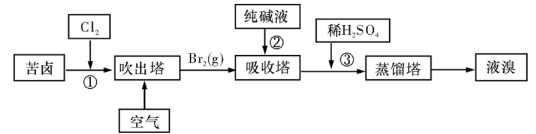
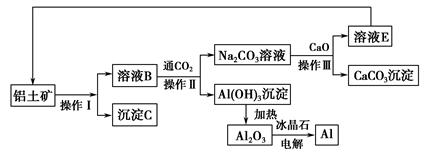
题目内容
工业上以黄铁矿为原料生产硫酸主要分为三个阶段进行,即煅烧、催化氧化、吸收。请回答下列问题:
(1)煅烧黄铁矿形成的炉气必须经除尘、洗涤、干燥后进入 (填设备名称),其主要目的是 。
(2)催化氧化所使用的催化剂钒触媒(V2O5)能加快二氧化硫氧化速率,此过程中产生了一连串的中间体(如图1)
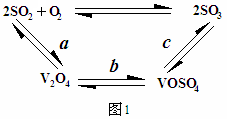
其中a、c二步反应的化学方程式可表示为: 、 。
(3)550℃时,SO2转化为SO3的平衡转化率(α)与体系总压强(P)的关系如图2所示,
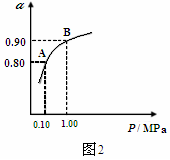
则:将2.0mol SO2和1.0mol O2置于5L密闭容器中,反应达平衡后,体系总压强为0.10M Pa,A与B表示不同压强下的SO2转化率,通常情况下工业生产中采用常压的原因是: 。
(4)为循环利用催化剂,科研人员最新研制了一种离子交换法回收钒的新工艺,回收率达91.7%以上。已知废钒催化剂中含有V2O5、VOSO4及不溶性残渣,查阅资料知:VOSO4可溶于水,V2O5难溶于水,NH4VO3难溶于水。该工艺的流程如图如下:
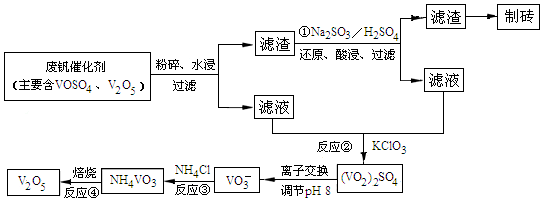
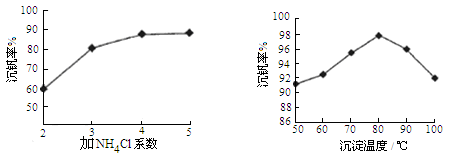
则反应①②③④中属于氧化还原反应的是 (填数字序号),反应①的离子方程式为 ,该工艺中反应③的沉淀率(又称沉钒率)是回收钒的关键之一,沉钒率的高低除受溶液pH影响外,还需要控制氯化铵系数(NH4Cl加入质量与料液中V2O5的质量比)和温度。根据下图试建议控制氯化铵系数和温度: 、 。
(1)煅烧黄铁矿形成的炉气必须经除尘、洗涤、干燥后进入 (填设备名称),其主要目的是 。
(2)催化氧化所使用的催化剂钒触媒(V2O5)能加快二氧化硫氧化速率,此过程中产生了一连串的中间体(如图1)

其中a、c二步反应的化学方程式可表示为: 、 。
(3)550℃时,SO2转化为SO3的平衡转化率(α)与体系总压强(P)的关系如图2所示,

则:将2.0mol SO2和1.0mol O2置于5L密闭容器中,反应达平衡后,体系总压强为0.10M Pa,A与B表示不同压强下的SO2转化率,通常情况下工业生产中采用常压的原因是: 。
(4)为循环利用催化剂,科研人员最新研制了一种离子交换法回收钒的新工艺,回收率达91.7%以上。已知废钒催化剂中含有V2O5、VOSO4及不溶性残渣,查阅资料知:VOSO4可溶于水,V2O5难溶于水,NH4VO3难溶于水。该工艺的流程如图如下:

则反应①②③④中属于氧化还原反应的是 (填数字序号),反应①的离子方程式为 ,该工艺中反应③的沉淀率(又称沉钒率)是回收钒的关键之一,沉钒率的高低除受溶液pH影响外,还需要控制氯化铵系数(NH4Cl加入质量与料液中V2O5的质量比)和温度。根据下图试建议控制氯化铵系数和温度: 、 。

(1)接触室 防止催化剂中毒
(2)SO2+V2O5 SO3+V2O4 VOSO4+O2
SO3+V2O4 VOSO4+O2 2V2O5+4SO3
2V2O5+4SO3
(3)在常压下SO2就可以达到较高的转化率
(4)①② V2O5+SO32﹣+4H+=2VO2++SO42﹣+2H2O 4 80℃
(2)SO2+V2O5
 SO3+V2O4 VOSO4+O2
SO3+V2O4 VOSO4+O2 2V2O5+4SO3
2V2O5+4SO3(3)在常压下SO2就可以达到较高的转化率
(4)①② V2O5+SO32﹣+4H+=2VO2++SO42﹣+2H2O 4 80℃
(1)黄铁矿燃烧生成的二氧化硫气体为防止催化剂中毒,经过除尘、洗涤、干燥后进入接触室催化氧化为三氧化硫;
(2)从已知信息知,V2O5起催化作用,a中V2O5变成了V2O4,说明V化合价降低,所以S元素的化合价升高,则发生的反应是SO2+V2O5 SO3+V2O4,同理在c中,V的化合价升高,则O元素的化合价降低,则发生的反应是VOSO4+O2
SO3+V2O4,同理在c中,V的化合价升高,则O元素的化合价降低,则发生的反应是VOSO4+O2 2V2O5+4SO3。
2V2O5+4SO3。
(3)二氧化硫催化氧化是气体体积减少的放热反应,依据化学平衡移动原理可知温度越低,压强越大,平衡越向正向进行,二氧化硫的转化率越大,但通过图象分析在常压下,二氧化硫的转化率已经很大,增大压强对提高二氧化硫的转化率提高不大,但增大压强会对设备有更高的要求,增加成本,所以通常情况下工业生产中采用常压;
(4)由所给的图示可知,属于氧化还原反应是①②;已知VOSO4可溶于水,V2O5难溶于水,废钒催化剂中含有V2O5、VOSO4及不溶性残渣水浸过滤后,得到的滤渣为不溶性杂质和V2O5,滤液为VOSO4的溶液,滤渣的成分是V2O5,在酸性条件下,亚硫酸根离子具有还原性,所以发生的反应是V2O5+SO32﹣+4H+=2VO2++SO42﹣。
(5)已知VOSO4可溶于水,V2O5难溶于水,NH4VO3难溶于水,①中加入亚硫酸钠的作用是还原V2O5为溶于水的VOSO4;②加入KClO3的目的,根据流程物质的变化可知将VOSO4氧化为(VO2)2SO4;③根据NH4VO3难溶于水,利用复分解反应沉淀VO3-,不是氧化还原反应,⑤NH4VO3变为V2O5是化合价不变的分解反应,不是氧化还原反应;沉钒率的高低除受溶液pH影响外,还需要控制氯化铵系数(NH4Cl加入质量与料液中V2O5的质量比)和温度,依据图象可知,温度80°C时的沉钒率最高为98%,在氯化铵系数图象中对应沉钒率98%时控制氯化铵系数为4和80℃。
(2)从已知信息知,V2O5起催化作用,a中V2O5变成了V2O4,说明V化合价降低,所以S元素的化合价升高,则发生的反应是SO2+V2O5
 SO3+V2O4,同理在c中,V的化合价升高,则O元素的化合价降低,则发生的反应是VOSO4+O2
SO3+V2O4,同理在c中,V的化合价升高,则O元素的化合价降低,则发生的反应是VOSO4+O2 2V2O5+4SO3。
2V2O5+4SO3。(3)二氧化硫催化氧化是气体体积减少的放热反应,依据化学平衡移动原理可知温度越低,压强越大,平衡越向正向进行,二氧化硫的转化率越大,但通过图象分析在常压下,二氧化硫的转化率已经很大,增大压强对提高二氧化硫的转化率提高不大,但增大压强会对设备有更高的要求,增加成本,所以通常情况下工业生产中采用常压;
(4)由所给的图示可知,属于氧化还原反应是①②;已知VOSO4可溶于水,V2O5难溶于水,废钒催化剂中含有V2O5、VOSO4及不溶性残渣水浸过滤后,得到的滤渣为不溶性杂质和V2O5,滤液为VOSO4的溶液,滤渣的成分是V2O5,在酸性条件下,亚硫酸根离子具有还原性,所以发生的反应是V2O5+SO32﹣+4H+=2VO2++SO42﹣。
(5)已知VOSO4可溶于水,V2O5难溶于水,NH4VO3难溶于水,①中加入亚硫酸钠的作用是还原V2O5为溶于水的VOSO4;②加入KClO3的目的,根据流程物质的变化可知将VOSO4氧化为(VO2)2SO4;③根据NH4VO3难溶于水,利用复分解反应沉淀VO3-,不是氧化还原反应,⑤NH4VO3变为V2O5是化合价不变的分解反应,不是氧化还原反应;沉钒率的高低除受溶液pH影响外,还需要控制氯化铵系数(NH4Cl加入质量与料液中V2O5的质量比)和温度,依据图象可知,温度80°C时的沉钒率最高为98%,在氯化铵系数图象中对应沉钒率98%时控制氯化铵系数为4和80℃。

练习册系列答案
相关题目
 2Na +Cl2↑
2Na +Cl2↑ Mg+ H2O
Mg+ H2O  3 Fe +4 CO2
3 Fe +4 CO2