��Ŀ����
����Ŀ������ͼ��ʾ��װ���У���ͨ��ֱ����![]() ʱ��ͭ�缫��������
ʱ��ͭ�缫��������![]() ���Իش�
���Իش�

![]() �缫�ķ�Ӧʽ____________
�缫�ķ�Ӧʽ____________
![]() �е���ʵ�Ũ��_____
�е���ʵ�Ũ��_____![]() ��������������С����������
������������������������![]() ��
��
![]() ͨ��
ͨ��![]() ʱ��B�й��ռ�
ʱ��B�й��ռ�![]() ����
����![]() ���
���![]() ����Һ���Ϊ
����Һ���Ϊ![]() ����ͨ��ǰ
����ͨ��ǰ![]() ��Һ�����ʵ���Ũ��Ϊ_______________
��Һ�����ʵ���Ũ��Ϊ_______________![]() ����ǰ����Һ����ޱ仯
����ǰ����Һ����ޱ仯![]() ��
��
![]() ��A��KCl��Һ�����Ҳ��
��A��KCl��Һ�����Ҳ��![]() ��������Һ��pHΪ_______
��������Һ��pHΪ_______![]() ����ǰ����Һ����ޱ仯
����ǰ����Һ����ޱ仯![]() ��A�е��������ӷ���ʽ��_________
��A�е��������ӷ���ʽ��_________
![]() ����Դ��Ϊ�����Ѽ���ȼ�ϵ�أ���X���ķ�Ӧ__________
����Դ��Ϊ�����Ѽ���ȼ�ϵ�أ���X���ķ�Ӧ__________
���𰸡�![]()
![]() ����
���� ![]()
![]()
![]()
![]()
��������
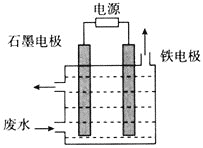
(1)���ݵ����е缫�ı仯���ж�����������д��ص缫��Ӧ��
(2)���ݵ��ԭ��������Ϊ�Ʋ���ϣ�����������Ӧ�����������ӽ�����Һ������������ԭ��Ӧ��������������ʧ�����غ㣬���Ե����Ũ�Ȳ��䣻
(3)��������������·�е���ת���غ㼰�缫��Ӧʽ��������ؼ��㡣
(4)���ݵ缫��Ӧʽ������������Ũ�ȣ���������pH��
(5)����ȼ�ϵ��ԭ������д�缫��Ӧʽ��
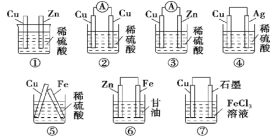
![]() ͭ�缫��������
ͭ�缫��������![]() ��˵��ͭ���Ϊ������������Ӧ
��˵��ͭ���Ϊ������������Ӧ![]()
![]() ���ʴ�Ϊ��
���ʴ�Ϊ��![]() ��
��
![]() ��Ϊ��Ƴأ���ҺŨ�Ȳ��䣬�ʴ�Ϊ�����䣻
��Ϊ��Ƴأ���ҺŨ�Ȳ��䣬�ʴ�Ϊ�����䣻
![]() ����ͭ�缫��������
����ͭ�缫��������![]() ����ͭ�缫����
����ͭ�缫����![]() ����������·��ת�Ƶ���
����������·��ת�Ƶ���![]() ��B�����ö��Ե缫��⣬����ˮ�ŵ�����������
��B�����ö��Ե缫��⣬����ˮ�ŵ�����������![]() ��B�й��ռ�
��B�й��ռ�![]() ����
����![]() ���
���![]() ����
����![]() ����������������
����������������![]() ��ת�Ƶ���
��ת�Ƶ���![]() ����
����![]() ���Ӹ�ͭ���ӣ���ͭ����
���Ӹ�ͭ���ӣ���ͭ����![]() ��
��![]() ���ʴ�Ϊ��
���ʴ�Ϊ�� ![]() ��
��
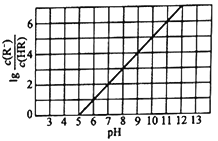
![]() ���Ƕ��Ե缫����Ȼ��أ��ܷ���ʽΪ
���Ƕ��Ե缫����Ȼ��أ��ܷ���ʽΪ![]() ��ת�Ƶ��ӵ����ʵ�����������������ͬ������������
��ת�Ƶ��ӵ����ʵ�����������������ͬ������������![]() ��Ũ��Ϊ
��Ũ��Ϊ![]() ��
��![]() ���ʴ�Ϊ��13��
���ʴ�Ϊ��13��![]() ��
��
![]() �����Ѽ���ȼ�ϵ��X��Ϊ�������缫��ӦʽΪ
�����Ѽ���ȼ�ϵ��X��Ϊ�������缫��ӦʽΪ![]() ���ʴ�Ϊ��
���ʴ�Ϊ��![]() ��
��

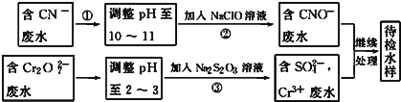
����Ŀ������ʵ���У���Ӧ�������Լ����ͻ���۶���ȷ�����߾��������ϵ����
ѡ�� | ʵ�� | ���� | ���ͻ���� |
A | ��������Ũ�����м�����Ƭ��һ��ʱ������ͭ�� | ���������ɣ���Һ������ɫ | Ũ���ὫFe����Ϊ |
B | �ֱ��� | ���а�ɫ�������� | �����ԣ� |
C | �����ڵ��������ݵ�ʢ��ʳ��ˮ�����������У����������Ӵ� | ������ù������� | ����ԭ��أ����������������õ��ӱ���ԭ�ɵ����� |
D | �� | ��ɫ������Ϊdz��ɫ |
|
A.AB.BC.CD.D