题目内容
14.甲、乙两烧杯中各盛有100mL 6mol/L的盐酸和NaOH溶液,向两烧杯中分别加入等质量的铝粉,反应结束后测得生成的气体体积比为1:2,则加入铝粉的质量为( )| A. | 10.8g | B. | 7.2g | C. | 5.4g | D. | 3.6g |
分析 发生2Al+6HCl=2AlCl3+3H2↑,2Al+2NaOH=2NaAlO2+3H2↑,酸碱足量时生成氢气相同,酸碱不足时生成氢气为1:3,则加入等质量的铝粉,反应结束后测得生成的气体体积比为1:2,可知酸不足、碱过量,以此来解答.
解答 解:NaOH、HCl的物质的量均为0.1L×6mol.L=0.6mol,测得生成的气体体积比为V(甲):V(乙)=1:2,所以生成的氢气物质的量之比是1:2,
设铝与酸完全反应时,生成的氢气的物质的量为x
2Al+6HCl=2AlCl3+3H2↑
6 3
0.6mol x
$\frac{6}{0.6mol}$=$\frac{3}{x}$
解得x=0.3mol,
一定条件下气体的物质的量之比等于体积之比,所以氢氧化钠和铝反应生成的氢气的物质的量为0.3mol×2=0.6mol,
碱与金属完全反应时,设碱与金属反应的物质的量为y
2Al+2NaOH=2NaAlO2+3H2↑
2 3
y 0.6mol
$\frac{2}{y}$=$\frac{3}{0.6mol}$
解得:y=0.4mol,
则铝的质量为0.4mol×27g/mol=10.8g,
故选A.
点评 本题考查化学方程式的计算,为高频考点,把握Al与酸碱反应的规律、过量判断为解答的关键,侧重分析与计算能力的考查,注意气体的体积比,题目难度不大.

练习册系列答案
相关题目
5.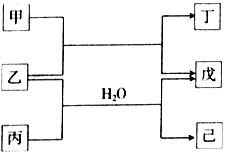 短周期元素E、R、X、Y、Z的原子序数依次增大,它们组成的单质或化合物存在如下转化关系,甲、丁为二元化合物,乙、戊为单质,丙、己为三元化合物.已知25℃时,0.1mol•L-1甲、丙两溶液的pH分别为1、13,丁、己两溶液混合时产生白色沉淀.下列说法正确的是( )
短周期元素E、R、X、Y、Z的原子序数依次增大,它们组成的单质或化合物存在如下转化关系,甲、丁为二元化合物,乙、戊为单质,丙、己为三元化合物.已知25℃时,0.1mol•L-1甲、丙两溶液的pH分别为1、13,丁、己两溶液混合时产生白色沉淀.下列说法正确的是( )
 短周期元素E、R、X、Y、Z的原子序数依次增大,它们组成的单质或化合物存在如下转化关系,甲、丁为二元化合物,乙、戊为单质,丙、己为三元化合物.已知25℃时,0.1mol•L-1甲、丙两溶液的pH分别为1、13,丁、己两溶液混合时产生白色沉淀.下列说法正确的是( )
短周期元素E、R、X、Y、Z的原子序数依次增大,它们组成的单质或化合物存在如下转化关系,甲、丁为二元化合物,乙、戊为单质,丙、己为三元化合物.已知25℃时,0.1mol•L-1甲、丙两溶液的pH分别为1、13,丁、己两溶液混合时产生白色沉淀.下列说法正确的是( )| A. | 原子半径的大小Z>Y>X>R>E | |
| B. | X、Y、Z的最高价氧化物对应的水化物能相互反应 | |
| C. | E、R、Z三种元素不可能存在于同一种共价化合物中 | |
| D. | Z的阴离子夺取质子的能力较R的阴离子强 |
2.下列鉴别物质的方法能达到目的是( )
| A. | 用氨水鉴别MgCl2溶液和AlCl3溶液 | |
| B. | 用澄清石灰水鉴别Na2CO3溶液和NaHCO3溶液 | |
| C. | 用KSCN溶液鉴别FeCl3溶液和FeCl2溶液 | |
| D. | 用淀粉溶液鉴别加碘盐和未加碘盐(己知加碘盐中添加的是KIO3) |
9.由实验测得同物质的量浓度的氢氧化钠溶液和硫酸铜溶液按体积比为1.5:1混合时,可生成一种沉淀物,沉淀后溶液中几乎无铜离子,则该沉淀物的化学式是( )
| A. | Cu(OH)2 | B. | 3Cu(OH)2•CuSO4 | C. | 2Cu(OH)2•CuSO4 | D. | Cu(OH)2•CuSO4 |
7.某有机物的分子式为C9H10O2,其属于芳香族化合物且能与Na2CO3反应产生气体的同分异构体有(不考虑、立体异构)( )
| A. | 15种 | B. | 14种 | C. | 13 种 | D. | 12种 |
8.化学反应中的能量变化是由化学反应中旧化学键断裂时吸收的能量与新化学键形成时放出的能量不同引起的.如图为N2(g)和O2(g)反应生成NO(g)过程中的能量变化:下列说法中正确的是( )


| A. | 1 mol N2(g)和1 mol O2(g)反应放出的能量为180 kJ | |
| B. | 1 mol N2(g)和1 mol O2(g)具有的总能量小于2 mol NO(g)具有的总能量 | |
| C. | 1 mol N2(g)和1 mol O2(g)具有的总键量小于2 mol NO(g)具有的总键量 | |
| D. | 通常情况下,N2(g)和O2(g)混合能直接生成NO |

 ;
; .
. .
. .
.
 .
. 、④
、④ 等,
等,