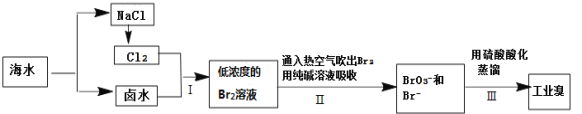
题目内容
【题目】向某 NaOH 溶液中通入 CO2 气体后得到溶液 M,因 CO2 通入的量不同, 溶液 M 的组成也不同,若向溶液 M 中逐滴加入盐酸,产生的气体体积 V(CO2)与加入盐酸的体积 V(HCl)的关系如图所示。则下列分析与判断 不正确的是(不计CO2溶解)

A. 若 OB=0,则形成溶液的过程中所发生反应的离子方程式为OH-+CO2=HCO3-
B. 若 OB=BC,则溶液 M 为Na2CO3 溶液
C. 若 OB>BC,则溶液 M 中大量存在的阴离子为 CO32-和HCO3-
D. 若 3OB=BC,则溶液 M 中 c(NaHCO3)=2c(Na2CO3)
【答案】C
【解析】
向NaOH溶液中通入CO2,可能发生的反应有CO2+2OH-=CO32-+H2O、CO2+OH-=HCO3-,向M溶液中滴加盐酸,涉及的反应可能有H++OH-=H2O、CO32-+H+=HCO3-、HCO3-+H+=H2O+CO2↑;
A.若OB=0,向M溶液中滴加盐酸,立即产生气体,则发生的离子方程式为HCO3-+H+=H2O+CO2↑,说明M为NaHCO3溶液,则形成M的过程中发生的离子方程式为CO2+OH-=HCO3-,故A正确;
B.若OB=BC,即OB段消耗的盐酸与BC段消耗的盐酸相等,OB段发生反应的离子方程式为CO32-+H+=HCO3-,即M溶液为Na2CO3溶液,故B正确;
C.若OB>BC,则OB段发生的反应有H++OH-=H2O,CO32-+H+=HCO3-,那么溶液M中大量存在的阴离子为OH-与CO32-,故C错误;
D.若3OB=BC,可根据CO32-+H+=HCO3-,HCO3-+H+=H2O+CO2↑进行计算,
BC段:CO32- + H+ = HCO3-,
1mol 1mol 1mol
OB段:HCO3- + H+ = H2O+CO2↑
3mol 3mol
M溶液中n(NaHCO3)=3mol-1mol=2mol,n(Na2CO3)=1mol,即n(NaHCO3)=2n(Na2CO3),所以c(NaHCO3)=2c(Na2CO3),故D正确,答案选C。