题目内容
【题目】从海水中提取溴的工业流程如图:
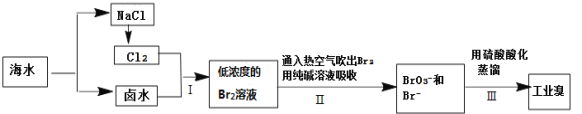
(1)以上步骤I中已获得游离态的溴,步骤Ⅱ又将之转变成化合态的溴,其目的是____。
(2)实验室保存液溴时,通常在盛液溴的试剂瓶中加少量的水,这与液溴的_____性质有关(填写序号)。
A 氧化性 B 还原性 C 挥发性 D 腐蚀性 E 密度比水大
(3)流程Ⅱ中将吹出的溴蒸气用纯碱溶液吸收时还有CO2生成,写出吸收时发生反应的离子方程式:__________。
(4)实验室分离溴水中的溴还可以用溶剂萃取法,下列可以用作溴的萃取剂的是____。(填序号)
A 四氯化碳 B 乙醇 C 烧碱溶液 D 苯
【答案】富集溴元素 CE 3Br2+3CO32-===BrO3-+5Br-+3CO2↑ AD
【解析】
根据流程分析可知:海水通过一定方法淡化得到淡水和卤水,卤水中加入氧化剂氧化溴离子为单质溴,通入热空气或水蒸气吹出Br2,利用的是溴单质的易挥发性,再利用酸溶液中溴酸根离子和溴离子发生氧化还原反应得到溴单质。
(1)步骤I中已获得游离态的溴浓度很低,如果直接蒸馏,生产成本较高,不利于工业生产,步骤I中已获得游离态的溴,步骤II又将之转变成化合态的溴,其目的是富集溴元素,降低成本,故答案为:富集溴元素。
(2)由于液溴易挥发,密度比水大,所以通常在盛液溴的试剂瓶中加少量的水,形成液封,故答案为:CE。
(3)溴蒸气与纯碱溶液反应的化学方程式为3Br2+3Na2CO3=== NaBrO3+5NaBr+3CO2↑,离子方程式为:3Br2+3CO32-===BrO3-+5Br-+3CO2↑,故答案为:3Br2+3CO32-===BrO3-+5Br-+3CO2↑。
(4)苯、四氯化碳与水互不相溶,溴在四氯化碳和在苯中溶解度比在水中的大,故可以用作溴的萃取剂的是苯和四氯化碳,故答案为:AD。