题目内容
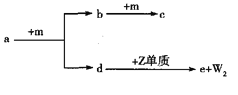
【题目】利用锌冶炼废渣(ZnSO4、CuSO4、FeSO4、FeS2、Al2O3、SiO2)制备ZnSO4和Fe2O3的实验流程如下:

已知:“碱浸”时,NaOH溶液浓度越大越粘稠,越容易生成铝硅酸钠沉淀。
(1) “水浸”阶段需在70~80℃条件下进行,适宜的加热方式为________________。
(2)“氧化”阶段是将Fe2+氧化后进一步生成Fe(OH)3,从反应产物的角度分析,以氯水替代H2O2的缺点是①使ZnSO4中混有ZnCl2;②________________。
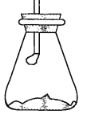
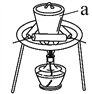
(3)“灼烧”时FeS2发生反应的化学方程式为________________。使用的装置如右图,仪器a的名称为________________。
(4) “碱浸”阶段,在其它条件不变的情况下,所得固体中Fe2O3含量随NaOH溶液的浓度的增大而增大,但当氢氧化钠浓度大于12 mol·L-1时,Fe2O3含量反而降低,其原因是________________。
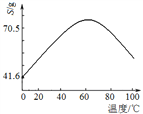
(5)“滤液Ⅰ”溶质主要是ZnSO4和CuSO4。已知硫酸锌晶体的溶解度随温度变化如右图,请设计从“滤液Ⅰ”中获取ZnSO4晶体的实验方案:________________(实验中须使用的试剂有:Zn粉、稀H2SO4、酒精)。
【答案】 水浴加热 引入H+使Fe3+不容易沉淀 4FeS2 + 11O2![]() 2Fe2O3 + 8SO2 坩埚 NaOH浓度大于12 mol·L-1时,生成的铝硅酸钠沉淀附着在反应物表面,使碱浸不完全 向滤液Ⅰ中加入过量的锌粉,过滤,在滤渣中加入稍过量稀硫酸,过滤,把两次过滤的滤液合并,保持60℃左右蒸发浓缩,冷却至室温结晶,过滤用酒精洗涤,干燥
2Fe2O3 + 8SO2 坩埚 NaOH浓度大于12 mol·L-1时,生成的铝硅酸钠沉淀附着在反应物表面,使碱浸不完全 向滤液Ⅰ中加入过量的锌粉,过滤,在滤渣中加入稍过量稀硫酸,过滤,把两次过滤的滤液合并,保持60℃左右蒸发浓缩,冷却至室温结晶,过滤用酒精洗涤,干燥
【解析】(1) “水浸”阶段需在70~80℃条件下进行,水的沸点为100℃,适宜的加热方式为水浴加热;(2)“氧化”阶段是将Fe2+氧化后进一步生成Fe(OH)3,从反应产物的角度分析,以氯水替代H2O2的缺点是①使ZnSO4中混有ZnCl2;②引入H+使Fe3+不容易沉淀;(3)“灼烧”时FeS2在空气中与氧气反应生成氧化铁和二氧化硫,发生反应的化学方程式为4FeS2 + 11O2![]() 2Fe2O3 + 8SO2;实验室用于灼烧固体的仪器是坩埚,则仪器a的名称为坩埚;(4)NaOH浓度大于12 mol·L-1时,生成的铝硅酸钠沉淀附着在反应物表面,使碱浸不完全,Fe2O3含量反而降低;(5)向滤液Ⅰ中加入过量的锌粉,过滤,在滤渣中加入稍过量稀硫酸,过滤,把两次过滤的滤液合并,保持60℃左右蒸发浓缩,冷却至室温结晶,过滤用酒精洗涤,干燥,得到ZnSO4晶体。
2Fe2O3 + 8SO2;实验室用于灼烧固体的仪器是坩埚,则仪器a的名称为坩埚;(4)NaOH浓度大于12 mol·L-1时,生成的铝硅酸钠沉淀附着在反应物表面,使碱浸不完全,Fe2O3含量反而降低;(5)向滤液Ⅰ中加入过量的锌粉,过滤,在滤渣中加入稍过量稀硫酸,过滤,把两次过滤的滤液合并,保持60℃左右蒸发浓缩,冷却至室温结晶,过滤用酒精洗涤,干燥,得到ZnSO4晶体。