题目内容
【题目】第VA族元素单质及其化合物在生产、生活中有重要的用途。
(1)下列说法正确的是__________(填序号)。
a.含氧酸的酸性:HNO3>H3PO4>H3AsO4 b.原子半径:S >P>As
c.氢化物的稳定性NH3>PH3> AsH3d.AsH3电子式是![]()
(2)雌黄(As2S3 )和雄黄(As4S4)都是自然界中常见的砷化物,早期都曾用作绘画颜料,因都有抗病毒疗效也用来入药。砷元素有+2、+3两种常见价态。一定条件下,雌黄和雄黄的转化关系如图所示。
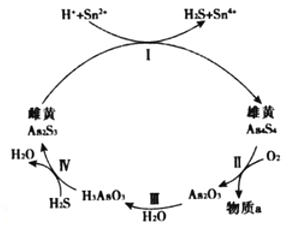
①Ⅱ中若1molAs4S4反应转移28mole-,a物质是__________。
②Ⅰ中反应的离子方程式是____________________________________。
(3)亚砷酸(H3AsO3)可以用于治疗白血病,其在溶液中存在多种微粒形态,各种微粒物质的量分数与溶液的pH关系如图所示。

①人体血液的pH在7.35~7.45 之间,用药后人体中含砷元素的主要微粒是___________。
②H3AsO3的一级电离常数是6×10-10mol·L-1,n(H3AsO3)∶n(H2AsO3-)=1∶1时,溶液的pH=___________(列出计算式即可)。
(4)由辉铋矿(主要成分为Bi2S3,含杂质PbO2等)制备Bi2O3的工艺如图所示:

①“浸出”时Bi2S3与FeCl3 溶液反应的离子方程式为________________________________。
②“置换”时生成单质铋的离子方程式为____________________________________。
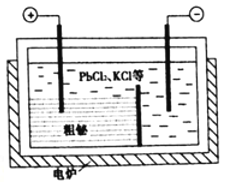
③“粗秘”中含有的杂质主要是Pb,通过熔融盐电解精炼可达到除杂的目的,其装置示意图如所示。电解后阳极底部留下的为精铋。写出阳极电极反应的方程式__________________________。
【答案】 ac SO2 2As2S3+4H++2Sn2+=2H2S+2Sn4++As4S4 H3AsO3 10-lg6 Bi2S3+6Fe3+=6Fe2++3S+2Bi3+ 2Bi3++3Fe=3Fe2++2Bi Pb-2e-=Pb2+
【解析】(1)a项,同主族元素,原子序数越大非金属性越弱,最高价氧化物对应水化物的酸性越弱,所以酸性:HNO3>H3PO4>H3AsO4,故a正确;b项,同周期元素原子序数越大半径越小,同主族元素原子序数越大半径越大,所以原子半径:S<P<As,故b错误;c项,同主族元素,原子序数越大非金属性越弱,氢化物的稳定性越小,所以稳定性:NH3>PH3>AsH3,故c正确;d项,AsH3电子式是![]() ,故d错误。
,故d错误。
(2)①如图所示,As4S4与O2反应,生成As2O3和物质a,1molAs4S4反应转移28mole-,根据得失电子守恒,1mol-3价的S失去7mole-,则生成+4价S的氧化物,故物质a为SO2。②反应Ⅰ为As2S3在酸性条件下与Sn2+反应生成As4S4、H2S和Sn4+,根据原子守恒和电荷守恒,离子方程式为:2As2S3+4H++2Sn2+=2H2S+2Sn4++As4S4。
(3)①由图像可得,pH在7.35~7.45之间时,含砷元素的主要微粒是H3AsO3。②H3AsO3的一级电离常数是6×10-10mol·L-1,则Ka1=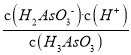 =6×10-10mol·L-1,又因为n(H3AsO3)∶n(H2AsO3-)=1∶1,则c(H3AsO3)=c(H2AsO3-),所以c(H+)=6×10-10mol·L-1,因此pH=-lgc(H+)=-lg(6×10-10)=10-lg6。
=6×10-10mol·L-1,又因为n(H3AsO3)∶n(H2AsO3-)=1∶1,则c(H3AsO3)=c(H2AsO3-),所以c(H+)=6×10-10mol·L-1,因此pH=-lgc(H+)=-lg(6×10-10)=10-lg6。
(4)①分析流程可得,辉铋矿加入FeCl3溶液和盐酸,FeCl3将-2价S氧化为S单质,同时生成FeCl2和BiCl2,盐酸可防止FeCl2和BiCl2水解生成不溶性沉淀,故“浸出”时Bi2S3与FeCl3溶液反应的离子方程式为:Bi2S3+6Fe3+=6Fe2++3S+2Bi3+。②浸出液主要含Fe2+和Bi3+,加入铁粉发生置换反应生成粗铋,离子方程式为:2Bi3++3Fe=3Fe2++2Bi。③“粗秘”中含有的杂质主要是Pb,通过熔融盐电解精炼可达到除杂的目的,电解后阳极底部留下的为精铋,则电解精炼时粗铋作阳极,Pb发生氧化反应生成Pb2+进入溶液,故阳极电极反应式为:Pb-2e-=Pb2+。