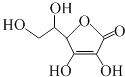
题目内容
【题目】在容积均为1 L的三个密闭容器中,分别放入铁粉并充入1 mol CO,控制在不同温度下发生反应:Fe(s)+5CO(g) ![]() Fe(CO)5(g),当反应进行到5min时,测得CO的体积分数与温度的关系如图所示。下列说法一定正确的是( )
Fe(CO)5(g),当反应进行到5min时,测得CO的体积分数与温度的关系如图所示。下列说法一定正确的是( )
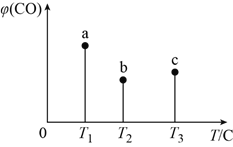
A. 反应进行到5min时,b容器中v(正)=v(逆)
B. 正反应为吸热反应,平衡常数:K(T1)>K(T2)
C. b中v(正)大于a中v(逆)
D. 达到平衡时,a、b、c中CO的转化率为b>c>a
【答案】C
【解析】A.5min时,b容器中的反应不一定是平衡状态,则v(正)、v(逆)不一定相等,故A错误;B. 温度越高,反应速率越快,根据b、c2点可知,升高温度,平衡逆向移动,说明正反应为放热反应,故B错误;C. 根据图像,a可能为平衡状态,v(正)≥v(逆),b是平衡状态,b的温度高,因此b平衡时的反应速率大于a平衡时的反应速率,因此b中v(正)大于a中v(逆),故C正确;D. 根据B的分析,正反应是放热反应,升高温度,平衡逆向移动,CO的转化率降低,达到平衡时,a、b、c中CO的转化率为a>b>c,故D错误;故选C。

【题目】如图是利用废铜屑(含杂质)制备胆矾(硫酸铜晶体)的过程 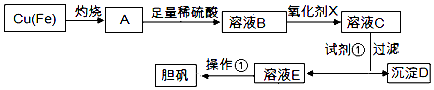
已知:
溶液中被沉淀的离子 | Fe3+ | Fe2+ | Cu2+ |
完全生成氢氧化物的沉淀时,溶液的pH | ≥3.7 | ≥6.4 | ≥4.4 |
请回答:
(1)下列物质中最适宜做氧化剂X的是(填字母).
A.NaClO
B.H2O2
C.KMnO4
D.FeCl3
(2)加入试剂①是为了调节pH,试剂①可以选择(填化学式).
(3)操作①的名称是 .
(4)沉淀D加入盐酸可以得到FeCl3溶液,关于FeCl3溶液的性质中说法不正确的是 .
A.将FeCl3饱和溶液逐滴加入沸水中,并继续加热得到红褐色液体,该液体能产生丁达尔效应
B.向FeCl3溶液滴加NaOH溶液,出现红褐色沉淀
C.将FeCl3溶液滴加NaOH溶液,将沉淀干燥灼烧,得到Fe(OH)3固体
D.向FeCl3溶液中滴加KSCN溶液,溶液变为红色
(5)沉淀D加入盐酸和铁粉,可以制得FeCl2溶液,实验室保存FeCl2溶液,需加入过量的铁粉防止FeCl2溶液变质,其原因是(用离子方程式表示).
(6)若用碳电极电解硫酸铜溶液200mL.通电5min后,阴极增重0.64g,则电解后溶液的pH=(溶液体积变化忽略不计).