题目内容
【题目】某酸性工业废水中含有一定量的Fe3+、Cu2+、Au3+等离子。利用常用的酸、碱和工业生产中废铁屑,设计如下工艺流程,从废水中回收金,并生产一定量的铁红和氧化铜。下列说法不正确的是
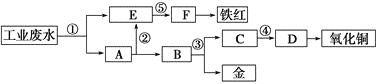
A.标号①②③处发生的反应均为氧化还原反应
B.标号③处加入的相应物质是稀硝酸
C.标号①处发生的离子反应最多有三个
D.铁红的化学式为Fe2O3,工业上常用作红色颜料
【答案】C
【解析】
由工艺流程图示知,E为铁元素的离子,而A为铜、金的混合物,通过过滤将铁元素与活泼性比它弱的铜、金分离出来,因此①处加入的物质为铁屑,发生的反应为Fe+2H+=Fe2++H2↑,2Fe3++Fe=3Fe2+,Cu2++Fe=Cu+Fe2+,2Au3++3Fe=2Au+3Fe2+;②处发生反应:Fe+2H+=Fe2++H2↑。加入稀硫酸以除去铜、金中过量的铁屑,并将过滤后的硫酸亚铁溶液与含Fe2+的E溶液相混合;③处发生反应:3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O,利用金不溶于硝酸的性质将铜与金分离开;④处发生反应:Cu2++2OH-=Cu(OH)2↓;将得到的铜离子用氢氧化钠转化为氢氧化铜沉淀,从而再受热分解为氧化铜;⑤处发生反应:Fe2++2OH-=Fe(OH)2↓;加入氢氧化钠将亚铁离子转化为氢氧化亚铁沉淀,再利用空气将其转化为氢氧化铁沉淀,最终受热分解为铁红(氧化铁),以此解答。
根据上述分析可知①为铁屑,②为稀硫酸,③为稀硝酸,④为NaOH,⑤为NaOH。A中含有Fe、Cu、Au,B中含有Cu、Au,C为Cu(NO3)2,D为Cu(OH)2,E中含有FeSO4,F中为Fe(OH)3,
A.由以上分析可知,标号①②③处发生的反应有元素化合价的变化,均为氧化还原反应,A正确;
B.标号③处加入的相应物质是稀硝酸,目的是分离铜和金单质,B正确;
C.由以上分析可知,标号①处发生的离子反应有:Fe+2H+=Fe2++H2↑,2Fe3++Fe=3Fe2+,Cu2++Fe=Cu+Fe2+,2Au3++3Fe=2Au+3Fe2+;最多有四个,C错误;
D. Fe2O3的俗名是铁红,工业上常用作红色颜料,D正确;
故合理选项是C。

 阅读快车系列答案
阅读快车系列答案【题目】硅是无机非金属材料的主角,硅芯片的使用,促进了信息技术的革命。
![]() 陶瓷、水泥和玻璃都属于传统硅酸盐材料。其中,生产普通玻璃的主要原料除了
陶瓷、水泥和玻璃都属于传统硅酸盐材料。其中,生产普通玻璃的主要原料除了![]() 、
、![]() 外还 ______,玻璃制作过程中发生了
外还 ______,玻璃制作过程中发生了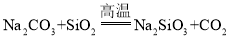 的反应,碳酸酸性强于硅酸,但为什么该反应可在高温下发生? ______。
的反应,碳酸酸性强于硅酸,但为什么该反应可在高温下发生? ______。
![]() 工业上提纯硅有多种路线,其中一种工艺流程示意图及主要反应如图:
工业上提纯硅有多种路线,其中一种工艺流程示意图及主要反应如图:
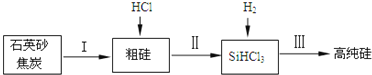
![]() 请写出反应Ⅱ、Ⅲ的化学方程式:Ⅱ ______、Ⅲ ______。
请写出反应Ⅱ、Ⅲ的化学方程式:Ⅱ ______、Ⅲ ______。
![]() 在流化床反应的产物中,
在流化床反应的产物中,![]() 大约占
大约占![]() ,所含有的其它物质的沸点数据如下表:
,所含有的其它物质的沸点数据如下表:
物质 | Si |
|
|
|
| HCl |
|
沸点 | 2355 |
|
|
|
|
|
|
提纯![]() 的主要工艺操作依次是沉降、冷凝和分馏
的主要工艺操作依次是沉降、冷凝和分馏![]() 相当于多次蒸馏
相当于多次蒸馏![]() 。沉降是为了除去 ______ ;在空气中冷凝所得液体主要含有 ______ ;若在实验室进行分馏提纯液体,应该采取以下加热方法中的 ______。
。沉降是为了除去 ______ ;在空气中冷凝所得液体主要含有 ______ ;若在实验室进行分馏提纯液体,应该采取以下加热方法中的 ______。
A.电炉加热![]() 酒精灯加热
酒精灯加热![]() 砂浴加热
砂浴加热![]() 水浴加热
水浴加热
![]() 极易水解,其完全水解时的反应方程式为 ______。
极易水解,其完全水解时的反应方程式为 ______。
【题目】某同学进行下列实验:
装置 | 操作 | 现象 |
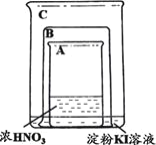
| 将盛有浓硝酸的烧杯A放入盛有淀粉KI溶液的烧杯C中,然后将铜片放入烧杯A后,立即用烧杯B罩住。 | 烧杯A液体上方立即出现大量红棕色气体;一段时间后,红棕色气体消失,烧杯A和C中的液体都变成蓝色。 |
下列说法不合理的是
A.烧杯A中发生反应:Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O
B.红棕色气体消失可能与NO2和烧杯C中的KI发生反应有关
C.烧杯A中溶液变蓝是因为产生了Cu(NO3)2
D.若将铜片换成铁片,则C中的液体不会变蓝