题目内容
【题目】有关物质的转化关系如图所示(部分物质与条件已略去).A、C、E、G是中学化学中常见的单质:通常状况下,E是密度最小的气体,G是黄绿色的气体,B 是常见的无色液体,F为强碱,D是某种具有磁性的金属矿物的主要成分,K受热分解可生成红棕色固体.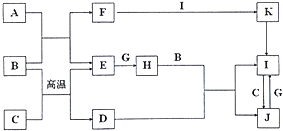
请回答下列问题:
(1)D的化学式为
(2)H的电子式为
(3)写出A与B反应的化学方程式:
(4)写出常温下G与F的溶液反应的离子方程式: .
【答案】
(1)Fe3O4
(2)![]()
(3)2Na+2H2O=2NaOH+H2↑
(4)Cl2+2OH﹣=Cl﹣+ClO﹣+H2O
【解析】解:A、C、E、G是中学化学中常见的单质,通常状况下,E是密度最小的气体,则E为H2 , G是黄绿色的气体,则G为Cl2 , E与G反应生成H为HCl,B是常见的无色液体,F为强碱,则A为Na、B为H2O、F为NaOH,D是某种具有磁性的金属矿物的主要成分,K受热分解可生成红棕色固体,K反应得到I,则C为Fe、D为Fe3O4 , 盐酸与四氧化三铁反应生成氯化亚铁、氯化铁,而I能与Fe反应得到G,G与氯气反应得到I,则I为FeCl3、G为FeCl2 , K为Fe(OH)3 , 符合转化关系.(1)D的化学式为Fe3O4 , 所以答案是:Fe3O4;(2)H为HCl,电子式为 ![]() ,所以答案是:
,所以答案是: ![]() ;(3)A与B反应的化学方程式:2Na+2H2O=2NaOH+H2↑,所以答案是:2Na+2H2O=2NaOH+H2↑;(4)常温下氯气与氢氧化钠溶液反应的离子方程式:Cl2+2OH﹣=Cl﹣+ClO﹣+H2O,所以答案是:Cl2+2OH﹣=Cl﹣+ClO﹣+H2O.
;(3)A与B反应的化学方程式:2Na+2H2O=2NaOH+H2↑,所以答案是:2Na+2H2O=2NaOH+H2↑;(4)常温下氯气与氢氧化钠溶液反应的离子方程式:Cl2+2OH﹣=Cl﹣+ClO﹣+H2O,所以答案是:Cl2+2OH﹣=Cl﹣+ClO﹣+H2O.

练习册系列答案
 黄冈天天练口算题卡系列答案
黄冈天天练口算题卡系列答案
相关题目