题目内容
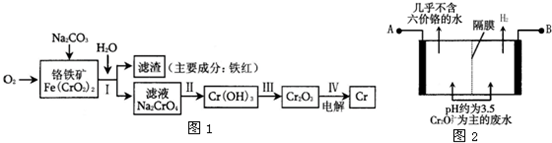
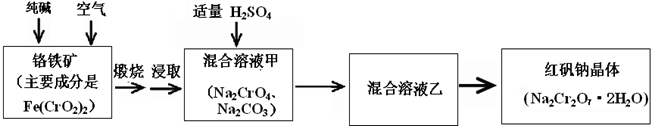
重铬酸钠俗称红矾钠(Na2Cr2O7?2H2O)是重要的化工产品和强氧化剂.工业制备的流程如下:
请回答:
(1)已知Fe(CrO2)2中铬元素是+3价,则Fe(CrO2)2中铁元素是______价.
(2)化学上可将某些盐写成氧化物的形式,如Na2SiO3可写成Na2O?SiO2,则Fe(CrO2)2可写成______.
(3)煅烧铬铁矿时,矿石中难溶的Fe(CrO2)2生成可溶于水的Na2CrO4,反应化学方程式如下:
4Fe(CrO2)2+8Na2CO3+7O2=2Fe2O3+8Na2CO4+8CO2
为了加快该反应的反应速率,可采取的措施是______.
(4)已知CrO42-在不同的酸性溶液中有不同的反应,如:
2CrO42-+2H+=Cr2O72-+H2O;
3CrO42-+4H+=Cr3O102-+2H2O
①往混合溶液甲中加入硫酸必须适量的原因是______.
②混合溶液乙中溶质的化学式是______.
(5)+3、+6价铬都有很强的毒性,+6价铬的毒性更高,可诱发肺癌和鼻咽癌,所以制取红矾钠后的废水中含有的Cr2O72-必须除去.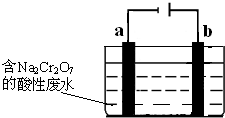
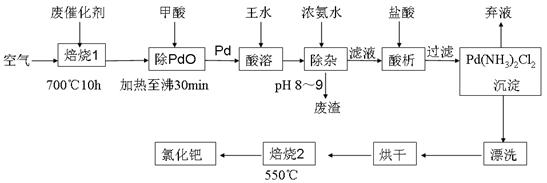
工业上可用电解法来处理含Cr2O72-的废水,如图为电解装置示意图(电极材料分别为铁和石墨).通电后,Cr2O72-在b极附近转变为Cr3+,一段时间后Cr3+最终可在a极附近变成Cr(OH)3沉淀而被除去.
a电极的电极反应式是______,b电极附近反应的离子方程式是______.

请回答:
(1)已知Fe(CrO2)2中铬元素是+3价,则Fe(CrO2)2中铁元素是______价.
(2)化学上可将某些盐写成氧化物的形式,如Na2SiO3可写成Na2O?SiO2,则Fe(CrO2)2可写成______.
(3)煅烧铬铁矿时,矿石中难溶的Fe(CrO2)2生成可溶于水的Na2CrO4,反应化学方程式如下:
4Fe(CrO2)2+8Na2CO3+7O2=2Fe2O3+8Na2CO4+8CO2
为了加快该反应的反应速率,可采取的措施是______.
(4)已知CrO42-在不同的酸性溶液中有不同的反应,如:
2CrO42-+2H+=Cr2O72-+H2O;
3CrO42-+4H+=Cr3O102-+2H2O
①往混合溶液甲中加入硫酸必须适量的原因是______.
②混合溶液乙中溶质的化学式是______.
(5)+3、+6价铬都有很强的毒性,+6价铬的毒性更高,可诱发肺癌和鼻咽癌,所以制取红矾钠后的废水中含有的Cr2O72-必须除去.

工业上可用电解法来处理含Cr2O72-的废水,如图为电解装置示意图(电极材料分别为铁和石墨).通电后,Cr2O72-在b极附近转变为Cr3+,一段时间后Cr3+最终可在a极附近变成Cr(OH)3沉淀而被除去.
a电极的电极反应式是______,b电极附近反应的离子方程式是______.
(1)Fe(CrO2)2中,氧元素的化合价是-2价,总的负价是-8价,铬元素的化合价是+3价,2个铬原子化合价是+6价,所以铁元素化合价是+2价,
故答案为:+2
(2)Fe(CrO2)2 中铁元素化合价是+2价,氧化物为FeO,铬元素化合价+3价,氧化物为Cr2O3,所以Fe(CrO2)2写成氧化物形式为FeO?Cr2O3,
故答案为:FeO?Cr2O3 ;
(3)增大反应物接触面积可以加快反应速率,升高温度可以大大加快反应速率,
故答案为:粉碎矿石、升高温度;
(4)①由于少量难以除尽碳酸钠,过量会发生反应3CrO42-+4H+=Cr3O102-+2H2O,生成了Na2Cr3O10等副产物,所以必须加入适量硫酸,
故答案为:少量不能除尽Na2CO3等杂质,过量会生成Na2Cr3O10等副产物;
②由于发生了反应2CrO42-+2H+=Cr2O72-+H2O,生成了Na2Cr2O7和Na2SO4,所以乙中溶质的化学式Na2Cr2O7和Na2SO4,
故答案为:Na2Cr2O7和Na2SO4;
(5)根据电解槽图示可知,a为阴极,溶液显示酸性,溶液中氢离子得到电子,发生还原反应,电极反应为:2H++2e-=H2↑,
b为阳极,铁失去电子生成亚铁离子,亚铁离子被Cr2O72-氧化成铁离子,反应的方程式为:Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O,
故答案为:2H++2e-=H2↑,Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O.
故答案为:+2
(2)Fe(CrO2)2 中铁元素化合价是+2价,氧化物为FeO,铬元素化合价+3价,氧化物为Cr2O3,所以Fe(CrO2)2写成氧化物形式为FeO?Cr2O3,
故答案为:FeO?Cr2O3 ;
(3)增大反应物接触面积可以加快反应速率,升高温度可以大大加快反应速率,
故答案为:粉碎矿石、升高温度;
(4)①由于少量难以除尽碳酸钠,过量会发生反应3CrO42-+4H+=Cr3O102-+2H2O,生成了Na2Cr3O10等副产物,所以必须加入适量硫酸,
故答案为:少量不能除尽Na2CO3等杂质,过量会生成Na2Cr3O10等副产物;
②由于发生了反应2CrO42-+2H+=Cr2O72-+H2O,生成了Na2Cr2O7和Na2SO4,所以乙中溶质的化学式Na2Cr2O7和Na2SO4,
故答案为:Na2Cr2O7和Na2SO4;
(5)根据电解槽图示可知,a为阴极,溶液显示酸性,溶液中氢离子得到电子,发生还原反应,电极反应为:2H++2e-=H2↑,
b为阳极,铁失去电子生成亚铁离子,亚铁离子被Cr2O72-氧化成铁离子,反应的方程式为:Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O,
故答案为:2H++2e-=H2↑,Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O.

练习册系列答案
相关题目