题目内容
美国科学家合成了含有N5+的盐类,含有该离子的盐是高能爆炸物质,该离子的结构呈“V”形,如图所示。以下有关该物质的说法中正确的是( )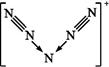
| A.每个N5+中含有35个质子和36个电子 |
| B.该离子中有非极性键和配位键 |
| C.该离子中含有2个π键 |
| D.与PCl4+互为等电子体 |
B
解析试题分析:A.N是7号元素,每个N原子含有7个质子和7个电子,而N5+是5个N原子失去1个电子后得到的。因此每个N5+中含有35个质子和34个电子.错误。B.N5+的结构式可以看出在该离子中有非极性键和配位键。正确。C.在该离子的每个N≡N中含有2个π键,而该离子中有两个N≡N。因此一共含有4个π键。错误。D.等电子体是原子数相同,价电子数目也相同的微粒。N5+与PCl4+原子数相同,但是价电子数目不同,因此不能互为等电子体。错误。
考点:考查等电子体、非极性键和配位键的概念及N5+的结构的知识。

 世纪百通主体课堂小学课时同步达标系列答案
世纪百通主体课堂小学课时同步达标系列答案 世纪百通优练测系列答案
世纪百通优练测系列答案 百分学生作业本题练王系列答案
百分学生作业本题练王系列答案有关CH2=CH-C≡N分子的说法正确的是
A.3个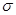 键,3个π键 键,3个π键 | B.4个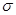 键,3个2π键 键,3个2π键 |
C.6个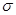 键,2个π键 键,2个π键 | D.6个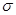 键,3个π键 键,3个π键 |
下列各项比较中前者高于(或大于或强于)后者的是
| A.CCl4和SiCl4的熔点 |
B.邻羟基苯甲醛(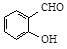 )和对羟基苯甲醛( )和对羟基苯甲醛(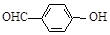 )的沸点 )的沸点 |
| C.SO2和CO2在水中的溶解度 |
| D.H2SO3和H2SO4的酸性 |
下列化合物中含有手性碳原子的是
| A.CCl2F2 | B.CH3CH3 | C.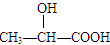 | D.CH3CH2OH |
北大和中科院已成功研制出碱金属与C60形成的球碳盐K3C60,实验测知该物质属于离子晶体,具有良好的超导性。有关分析正确的是
| A.K3C60中只有离子键 | B.K3C60中碳元素显-3价 |
| C.该晶体在熔融状态下能导电 | D.该晶体熔点较低 |
甲烷分子(CH4)失去一个H+,形成甲基阴离子(CH3-),在这个过程中,下列描述不合理的是( )
| A.碳原子的杂化类型发生了改变 |
| B.微粒的形状发生了改变 |
| C.微粒的稳定性发生了改变 |
| D.微粒中的键角发生了改变 |
下列物质中既含有共价键又含离子键的化合物是
| A.MgCl2 | B.NaOH | C.K2O | D.C6H6 |
下列叙述正确的是
①两种原子构成的共价化合物分子中的化学键都是极性键
②两种不同非金属元素原子间形成的化学键都是极性键
③含有非极性键的化合物一定是共价化合物
④只要是离子化合物,其熔点就比共价化合物的熔点高
⑤难失去电子的原子,易形成阴离子
⑥单质分子中不存在化学键,化合物的分子中才存在化学键
⑦离子化合物中一定含有离子键
| A.①⑦ | B.①⑤⑦ | C.⑦ | D.②⑦ |
北京大学和中国科学院的化学工作者已成功研制出碱金属与C60形成的球碳盐K3C60,实验测知该物质属于离子化合物,具有良好的超导性。下列有关分析正确的是( )
| A.K3C60中只有离子键 |
| B.K3C60中不含共价键 |
| C.该晶体在熔融状态下能导电 |
| D.C60与12C互为同素异形体 |