题目内容
北大和中科院已成功研制出碱金属与C60形成的球碳盐K3C60,实验测知该物质属于离子晶体,具有良好的超导性。有关分析正确的是
| A.K3C60中只有离子键 | B.K3C60中碳元素显-3价 |
| C.该晶体在熔融状态下能导电 | D.该晶体熔点较低 |
C
解析试题分析:A、K3C60中不仅存在离子键,C与C之间还存在共价键,错误;B、K3C60中碳元素整体显-3价,错误;C、离子晶体在熔融状态下都可以导电,正确;D、离子晶体的熔点较高,错误,答案选C。
考点:考查对已知信息的分析判断能力

练习册系列答案
相关题目
下列各组中的分子,全部是以极性键形成非极性分子的是
| A.H2、N2、Cl2 | B.CH4、NH3、H2O |
| C.HCl、NO、Br2 | D.CO2、CS2、CCl4 |
某致基因突变物质的结构简式如图。下列相关分析正确的是
| A.电负性:C<N<O |
| B.该分子中σ键与π键数目之比为4:2 |
| C.该分子所有原子处于同一平面 |
D.该分子的加聚产物为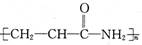 |
下列各组物质的晶体中,化学键类型相同、晶体类型也相同的是
| A.SO2和SiO2 | B.CO2和H2 | C.NaCl和HCl | D.CCl4和KCl |
实验测得 BeCl2为共价化合物,两个Be—Cl键间的夹角为180°。由此可见,BeCl2属于( )
| A.由极性键构成的极性分子 | B.由极性键构成的非极性分子 |
| C.由非极性键构成的极性分子 | D.由非极性键构成的非极性分子 |
美国科学家合成了含有N5+的盐类,含有该离子的盐是高能爆炸物质,该离子的结构呈“V”形,如图所示。以下有关该物质的说法中正确的是( )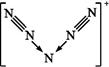
| A.每个N5+中含有35个质子和36个电子 |
| B.该离子中有非极性键和配位键 |
| C.该离子中含有2个π键 |
| D.与PCl4+互为等电子体 |
第28届国际地质大会提供的资料显示,海底有大量的天然气水合物,可满足人类1000年的能源需要。天然气水合物是一种晶体,晶体中平均每46个水分子构建成8个笼,每个笼可容纳1个CH4分子或1个游离H2O分子。下列关于天然气水合物中两种分子极性的描述正确的是 。
| A.两种都是极性分子 |
| B.两种都是非极性分子 |
| C.CH4是极性分子,H2O是非极性分子 |
| D.H2O是极性分子,CH4是非极性分子 |
下列变化需克服相同类型作用力的是
| A.碘和干冰的升华 | B.硅和C60的熔化 |
| C.氯化氢和氯化钾的溶解 | D.溴和汞的气化 |
下列组合中,中心离子的电荷数和配位数均相同的是( )
| A.K[Ag(CN)2]、[Cu(NH3)4]SO4 |
| B.[Ni(NH3)4]Cl2、[Cu(NH3)4]SO4 |
| C.[Ag(NH3)2]Cl、[Cu(NH3)2]Cl2 |
| D.[Ni(NH3)4]Cl2、[Ag(NH3)2]Cl |