题目内容
下列各项比较中前者高于(或大于或强于)后者的是
| A.CCl4和SiCl4的熔点 |
B.邻羟基苯甲醛(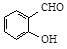 )和对羟基苯甲醛( )和对羟基苯甲醛(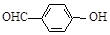 )的沸点 )的沸点 |
| C.SO2和CO2在水中的溶解度 |
| D.H2SO3和H2SO4的酸性 |
C
解析试题分析:A、CCl4和SiCl4都是由分子构成的物质,由于SiCl4的相对分子质量大于CCl4,分子间作用力也比CCl4大,所以广泛分子间作用力使物质熔化消耗的能量及高,因而其熔点也比CCl4高。错误。B、邻羟基苯甲醛(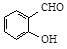 )和对羟基苯甲醛(
)和对羟基苯甲醛( )都属于分子晶体。由于在后者的分子之间还存在氢键,增加了分子之间的相互作用。所以后者的沸点高。错误。C、SO2在水中的溶解度为1:40;而CO2在水中的溶解度是1:1.因此前者大于后者。正确。D、H2SO3是弱酸,而H2SO4是强酸。所以酸性后者强。错误。
)都属于分子晶体。由于在后者的分子之间还存在氢键,增加了分子之间的相互作用。所以后者的沸点高。错误。C、SO2在水中的溶解度为1:40;而CO2在水中的溶解度是1:1.因此前者大于后者。正确。D、H2SO3是弱酸,而H2SO4是强酸。所以酸性后者强。错误。
考点:考查物质的微粒或化学性质的比较的知识。

练习册系列答案
 能力评价系列答案
能力评价系列答案 唐印文化课时测评系列答案
唐印文化课时测评系列答案
相关题目
下列晶体属于离子晶体的是
| A.镁 | B.干冰 | C.氟化钾 | D.金刚石 |
下列叙述正确的是( )
| A.离子化合物中一定含有金属元素 |
| B.金属元素不可能存在于阴离子中 |
| C.含有非极性键的化合物不一定是共价化合物 |
| D.由两种元素构成的共价化合物分子中的化学键都是极性键 |
某致基因突变物质的结构简式如图。下列相关分析正确的是
| A.电负性:C<N<O |
| B.该分子中σ键与π键数目之比为4:2 |
| C.该分子所有原子处于同一平面 |
D.该分子的加聚产物为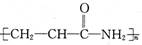 |
下列对一些实验事实的理论解释正确的是
| 选项 | 实验事实 | 理论解释 |
| A | 氮原子的第一电离能大于氧原子 | 氮原子2p能级半充满 |
| B | CO2为直线形分子 | CO2分子中C—O是极性键 |
| C | 金刚石的熔点低于石墨 | 金刚石是分子晶体,石墨是原子晶体 |
| D | HF的沸点高于HCl | HF的相对分子质量小于HCl |
下列各组物质的晶体中,化学键类型相同、晶体类型也相同的是
| A.SO2和SiO2 | B.CO2和H2 | C.NaCl和HCl | D.CCl4和KCl |
美国科学家合成了含有N5+的盐类,含有该离子的盐是高能爆炸物质,该离子的结构呈“V”形,如图所示。以下有关该物质的说法中正确的是( )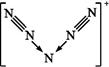
| A.每个N5+中含有35个质子和36个电子 |
| B.该离子中有非极性键和配位键 |
| C.该离子中含有2个π键 |
| D.与PCl4+互为等电子体 |
下列分子的中心原子的杂化类型与其他不同的是
| A.SiCl4 | B.H2S | C.PCl5 | D.NH3 |
下列反应过程中,同时有离子键、极性共价键和非极性共价键断裂和形成的反应是( )。
A.NH4Cl NH3↑+HCl↑ NH3↑+HCl↑ |
B.NH3+CO2+H2O NH4HCO3 NH4HCO3 |
C.2NaOH+Cl2 NaCl+NaClO+H2O NaCl+NaClO+H2O |
D.2Na2O2+2CO2 2Na2CO3+O2 2Na2CO3+O2 |