��Ŀ����
����Ŀ����ѡ��3�����ʽṹ�����ʡ�
�ڵ��ұ�����Ĺ����м������ʯ��������Al2O3�۵�����á�����ʯ������ԭ��Ϊ2Al(OH)3+12HF+3Na2CO3�T2Na3AlF6+3CO2��+9H2O�������������������գ�
��1������ʯ�ľ��岻���磬������ʱ�ܵ��磬���ڱ���ʯ�����д���__________(�����)��
a�����Ӽ� b�����Լ� c����λ�� d�����»���
��2��CO2���ӵĿռ乹��Ϊ__________������ԭ�ӵ��ӻ���ʽΪ__________����CO2 ��Ϊ�ȵ��������������__________��
��3����Ӧ���е縺������Ԫ��Ϊ_________(��Ԫ�ط���)��д����ԭ�������ĵ����Ų�ͼ__________��
��4������ʯ�����������ɣ�����ʯ�ľ����ṹ��ͼ����ʾ����λ�ڴ�������Ķ�������ģ���λ�ڴ��������12������е��8��С����������ģ���ô������������Ĵ�������������______(������������)��
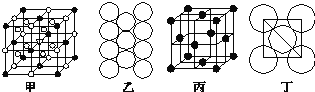
��5��Al���ʵľ�����ԭ�ӵĶѻ���ʽ��ͼ����ʾ���侧��������ͼ����ʾ��ԭ��֮���λ�ù�ϵ��ƽ��ͼ��ͼ����ʾ��
����֪Al��ԭ�Ӱ뾶Ϊd cm��NA��������٤��������Al�����ԭ������ΪM����һ��������Alԭ�ӵ���ĿΪ_________����Al������ܶ�Ϊ__________(����ĸ��ʾ)��
���𰸡���1��abc��2��ֱ���� sp N2O ��3��F ![]() ��4��Na+ ��5��
��4��Na+ ��5��![]() g��cm-3
g��cm-3
��������
�����������1������ʯ(Na3AlF6)���岻���磬������ʱ�ܵ��磬˵���������ӻ������Na+��[AlF6]3-���ɣ�[AlF6]3-�к�����λ����Ҳ���ڼ��Լ�����ѡabc��
��2��CO2����Ϊֱ���νṹ����֪̼ԭ�Ӳ�ȡsp�ӻ���ʽ��ԭ����Ŀ��ȡ��۵�������Ҳ��ȵ�����Ϊ�ȵ����壬��CO2 ��Ϊ�ȵ��������������N2O��
��3��Ԫ�صķǽ�����Խǿ����縺��Խǿ�����Ե縺����ǿ����FԪ�أ�Fԭ�Ӻ����������s��p�ܼ���s��p�ܼ��ϵ��ӷֱ���2��5�������������ʾʽΪ![]() ��
��
��4����ĸ���=8��![]() +6��
+6��![]() =4�������=12��
=4�������=12��![]() +8=11��Ҫʹ�������ӵĸ���֮��Ϊ1��3���������������Ĵ�������������Na+��
+8=11��Ҫʹ�������ӵĸ���֮��Ϊ1��3���������������Ĵ�������������Na+��
��5��������Alԭ�Ӹ���Ϊ=8��![]() +6��
+6��![]() =4��������4��
=4��������4��![]() g����Խ�����3��Alԭ�����ڣ������ⳤΪ4d��
g����Խ�����3��Alԭ�����ڣ������ⳤΪ4d��![]() =2
=2![]() d�����ܶ�=4��
d�����ܶ�=4��![]() =
=![]() g��cm-3��
g��cm-3��

 ��ĩ���䵥Ԫ�����ิϰ��ϵ�д�
��ĩ���䵥Ԫ�����ิϰ��ϵ�д�









