题目内容
【题目】锂—磷酸氧铜电池正极的活性物质是Cu4O(PO4)2,可通过下列反应制备:2Na3PO4+4CuSO4+2NH3H2O═Cu4O(PO4)2↓+3Na2SO4+(NH4)2SO4+H2O
(1)写出基态Cu2+的电子排布式:____________;与Cu同周期的元素中,与铜原子最外层电子数相等的元素还有____________(填元素符号)。
(2)PO43-的空间构型是____________。
(3)与SO42-互为等电子体的2种分子是______。
(4)氨水溶液中各元素原子的电负性从大到小排列顺序为_______________.
(5)氨基乙酸铜(结构简式:H2NCH2COO-Cu-OOC-CH2NH2)分子中碳原子的杂化方式为____________,基态碳原子核外电子占有_________个轨道。
(6)在硫酸铜溶液中加入过量KCN,生成配合物[Cu(CN)4]2-,则1mol该配合物中含有的π键的物质的量为__________mol。
(7)铜晶体为面心立方最密堆积,配位数为___________,铜的原子半径为127.8pm,NA表示阿伏加德罗常数的值,列出晶体铜的密度计算式(不必化简)__________g/cm-3
【答案】 [Ar]3d9 K、Cr 正四面体 SiF4 、CCl4 、CF4、SiCl4等 O>N>H sp3、sp2 4 8 12 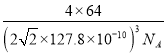
【解析】(1)考查电子排布式的书写、核外电子排布规律,Cu的价电子排布式为3d104s1,即Cu2+电子排布式为[Ar]3d9;与铜原子最外层电子数相等的元素是K、Cr;(2)考查空间构型,PO43-中中心原子有4个σ键,孤电子对数为(5+3-4×2)/2=0,价层电子对数为4,即PO43-的空间构型为正四面体;(3)考查等电子体,与SO42-等电子体的分子有SiF4 、CCl4 、CF4、SiCl4等;(4)考查电负性的规律,氨水中含有的元素是N、H、O,电负性的顺序是O>N>H;(5)考查杂化类型的判断,电子排布式,氨基乙酸铜中-CH2-,该碳原子的杂化类型为sp3,氨基乙酸铜中“C=O”中C原子的杂化类型为sp2;基态C原子的电子排布式为1s22s22p2,一个p能级有3个原子轨道,1个s能级有1个原子轨道,即基态碳原子核外电子占有4个原子轨道;(6)考查化学键的数目,CN-中C和N共有三个电子对,其中有2个π键,即1mol该配合物中含有π键的物质的量为8mol;(7)考查晶胞的计算,铜晶体为面心立方最密堆积,配位数为12,两个最近的铜原子距离是面对角线的一半,即面对角线距离为4×127.8×10-10cm,根据勾股定理,求出边长为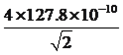 cm,晶胞的体积为(
cm,晶胞的体积为(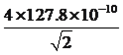 )3cm3,铜原子位于顶点和面心,个数为8×1/8+6×1/2=4,即晶胞的质量为
)3cm3,铜原子位于顶点和面心,个数为8×1/8+6×1/2=4,即晶胞的质量为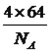 g,根据密度的定义,晶胞的密度为
g,根据密度的定义,晶胞的密度为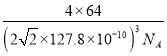 g/cm3。
g/cm3。

 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案