题目内容
14.下面有关13C、15N的叙述正确的是( )| A. | 13C与15N有相同的中子数 | B. | 13C与C60互为同位素 | ||
| C. | 15N与14N互为同位素 | D. | 15N的核外电子数与中子数相同 |
分析 A、中子数=质量数-质子数;
B、C60是一个分子,不属于核素;
C、质子数相同中子数不同的同一元素互称同位素;
D、原子中核外电子数=核内质子数、中子数=质量数-质子数.
解答 解:A、13C与15N有相同的中子数分别为:13-6=7,15-7=8,两者不相等,故A错误;
B、同一元素的不同核素互为同位素,C60是一个分子,不属于核素,故B错误;
C、14N与15N的质子数都为7,中子数分别为:14-7=7,15-7=8,两者不相等,属于同位素,故C正确;
D、15N的核外电子数是7,中子数是15-7=8,两者不相等,故D错误.
故选C.
点评 本题考查原子中的数量关系,明确质子数、中子数、质量数的关系,质子数与电子数的关系等即可解答,注重基础知识的考查,题目难度不大.

练习册系列答案
 快乐暑假暑假能力自测中西书局系列答案
快乐暑假暑假能力自测中西书局系列答案
相关题目
2.有机物 不能发生的反应是( )
不能发生的反应是( )
 不能发生的反应是( )
不能发生的反应是( )| A. | 酯化 | B. | 取代 | C. | 消去 | D. | 水解 |
9.如图图示与对应的叙述相符的是( )
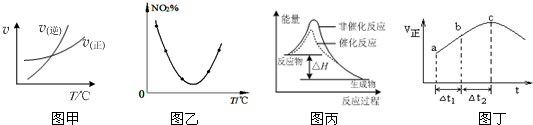

| A. | 由图甲表示的反应速率随温度变化的关系可知该反应的△H>0 | |
| B. | 图乙表示等量NO2在容积相同的恒容密闭容器中,不同温度下分别发生反应:2NO2(g)═N2O4(g),相同时间后测得NO2含量的曲线,则该反应的△H<0 | |
| C. | 图丙表示该反应为放热反应,且催化剂能改变反应的焓变 | |
| D. | 绝热恒容密闭容器中发生反应:SO2(g)+NO2(g)?SO3(g)+NO(g),其正反应速率随时间变化如图丁所示,则c点一定是平衡点 |
4.某温度下,0.021mol•L-1NaHSO3溶液的pH约为3.下列有关说法中正确的是( )
| A. | c(HSO3-)+2c(SO32-)+c(H2SO3)=0.021mol•L-1 | |
| B. | c(OH-)+c(SO32-)=c(H2SO3)+c(HSO3-) | |
| C. | $\frac{c({H}^{+})•c(S{O}_{3}^{2-})}{c(HS{O}_{3}^{-})}$约为5×10-5 | |
| D. | 加水稀释10倍后,溶液的pH=4 |
5.下列实验装置设计正确,且能达到实验目的是( )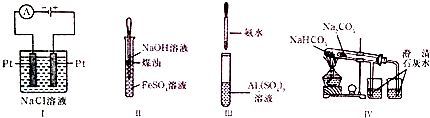

| A. | 实验Ⅰ:制备金属钠 | B. | 实验Ⅱ:制取Fe(OH)2并观察其颜色 | ||
| C. | 实验Ⅲ:制取NaAlO2 | D. | 实验Ⅳ:比较两种物质的热稳定性 |
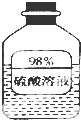 (1)如图信息,瓶中溶液长期放置后溶质质量分数变小,是因为该物质具有吸水性.
(1)如图信息,瓶中溶液长期放置后溶质质量分数变小,是因为该物质具有吸水性. 中学化学中几种常见物质的转化关系如图所示,且已知将F的饱和溶液滴入沸水中,煮沸可得到以H为分散质的红褐色胶体.请回答下列问题:
中学化学中几种常见物质的转化关系如图所示,且已知将F的饱和溶液滴入沸水中,煮沸可得到以H为分散质的红褐色胶体.请回答下列问题:
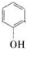 +2CH2=C(CH3)2→
+2CH2=C(CH3)2→