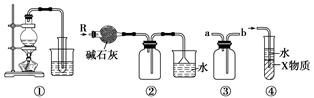
题目内容
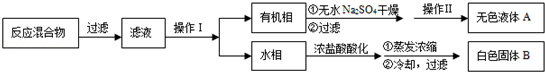
(18分)空气吹出法工艺,是目前“海水提溴”的最主要方法之一。其工艺流程如下:
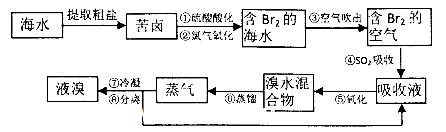
(1)氯元素在周期表中位于_______ 周期_______族。
(2)步骤①中用硫酸酸化可提高Cl2的利用率,理由是________ 。
(3)步骤④利用了SO2的还原性,反应的离子方程式为_________ __。
(4)步骤⑥的蒸馏过程中,温度应控制在80~90℃温度过高或过低都不利于生产,请解释原因____________________________.
(5)步骤⑧中溴蒸气冷凝后得到液溴与溴水的混合物,可利用它们的相对密度相差很大的特点进行分离。分离仪器的名称是__________。
(6)步骤①、②之后并未直接用“含Br2的海水”进行蒸馏得到液溴,而是经过“空气吹出”、“SO2吸收”、“氧化”后再蒸馏,这样操作的意义是__________。

(1)氯元素在周期表中位于_______ 周期_______族。
(2)步骤①中用硫酸酸化可提高Cl2的利用率,理由是________ 。
(3)步骤④利用了SO2的还原性,反应的离子方程式为_________ __。
(4)步骤⑥的蒸馏过程中,温度应控制在80~90℃温度过高或过低都不利于生产,请解释原因____________________________.
(5)步骤⑧中溴蒸气冷凝后得到液溴与溴水的混合物,可利用它们的相对密度相差很大的特点进行分离。分离仪器的名称是__________。
(6)步骤①、②之后并未直接用“含Br2的海水”进行蒸馏得到液溴,而是经过“空气吹出”、“SO2吸收”、“氧化”后再蒸馏,这样操作的意义是__________。
(1)第三,ⅦA;(2)酸化可抑制Cl2、Br2与水反应;
(3)Br2+SO2+2H2O=4H++2Br-+SO42-;
(4)温度过高,产生大量水蒸气,溴蒸气中水蒸气增加;温度过低,溴不能完全蒸出,吸收率低;(5)分液漏斗;(6)“空气吹出、SO2吸收、氧化”的过程实际上是一个溴单质的浓缩过程,与直接蒸馏含Br2海水相比效率更高,消耗能源少,成本降低。
(3)Br2+SO2+2H2O=4H++2Br-+SO42-;
(4)温度过高,产生大量水蒸气,溴蒸气中水蒸气增加;温度过低,溴不能完全蒸出,吸收率低;(5)分液漏斗;(6)“空气吹出、SO2吸收、氧化”的过程实际上是一个溴单质的浓缩过程,与直接蒸馏含Br2海水相比效率更高,消耗能源少,成本降低。
试题分析:(1)17号元素氯元素在周期表中位于第三周期第ⅦA族。(2)步骤①中用硫酸酸化可提高Cl2的利用率,原因是酸化可抑制Cl2、Br2与水反应;(3)在步骤④中SO2与溴水发生氧化还原反应,该反应的离子方程式为Br2+SO2+2H2O=4H++2Br-+SO42-;(4)步骤⑥的蒸馏过程中,温度应控制在80~90℃温度过高或过低都不利于生产,是因为温度过高,产生大量水蒸气,溴蒸气中水蒸气增加;若是温度过低,溴又不能完全蒸出,吸收率低;(5)步骤⑧中溴蒸气冷凝后得到液溴与溴水的混合物,可利用它们的相对密度相差很大的特点进行分离。密度大的在下层,密度小的在上层,这种分离混合物的方法叫分液,使用的分离仪器的名称是分液漏斗; (6)步骤①、②之后并未直接用“含Br2的海水”进行蒸馏得到液溴,而是经过“空气吹出”、“SO2吸收”、“氧化”后再蒸馏,这样操作的意义是“空气吹出、SO2吸收、氧化”的过程实际上是一个溴单质的浓缩过程,与直接蒸馏含Br2海水相比效率更高,消耗能源少,成本降低。

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
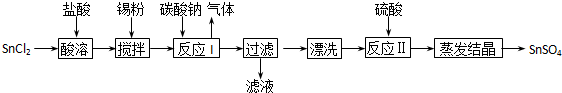
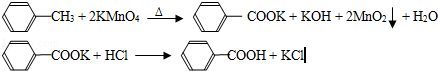
 (铁氧磁体,罗马数字表示元素价态)的沉淀。处理1mol Cr2O72-,需加入a mol FeSO4 ? 7H2O,下列结论正确的是_______。
(铁氧磁体,罗马数字表示元素价态)的沉淀。处理1mol Cr2O72-,需加入a mol FeSO4 ? 7H2O,下列结论正确的是_______。