题目内容
对于放热反应:H2+Cl2
2HCl,下列说法错误的是( )
| ||
| A、反应物的总能量大于生成物的总能量 |
| B、该反应遵循“能量守恒定律” |
| C、该反应中,化学能只转变成热能 |
| D、断开1mol H-H键和1mol Cl-Cl键所吸收的总能量小于形成2mol H-Cl键所放出的能量 |
考点:反应热和焓变
专题:化学反应中的能量变化
分析:A、根据放热反应中反应物所具有的总能量高于产物所具有的总能量;
B、任何化学反应都遵循能量守恒定律;
C、根据放热反应中化学能转变为热能、光能等;
D、根据放热反应的本质是生成物成键释放的总能量大于反应物断键吸收的总能量;
B、任何化学反应都遵循能量守恒定律;
C、根据放热反应中化学能转变为热能、光能等;
D、根据放热反应的本质是生成物成键释放的总能量大于反应物断键吸收的总能量;
解答:
解:氢气在氯气中燃烧是放热反应,
A、因H2+Cl2
2HCl是放热反应,所以反应物所具有的总能量高于产物所具有的总能量,故A正确;
B、任何化学反应都遵循能量守恒定律,故B正确;
C、因放热反应中化学能转变为热能、光能等,不是全部转变为热能,故C错误;
D、因放热反应的本质是生成物成键释放的总能量大于反应物断键吸收的总能量,故D正确;
故选:C.
A、因H2+Cl2
| ||
B、任何化学反应都遵循能量守恒定律,故B正确;
C、因放热反应中化学能转变为热能、光能等,不是全部转变为热能,故C错误;
D、因放热反应的本质是生成物成键释放的总能量大于反应物断键吸收的总能量,故D正确;
故选:C.
点评:本题主要考查了化学反应的本质以及能量变化的宏观和微观原因,难度不大.

练习册系列答案
相关题目
下列有关溶液的叙述中,正确的是( )
| A、中和10mL 0.1mol?L-1醋酸与中和100mL 0.01mol?L-1的醋酸所需同种碱溶液的量不同 |
| B、常温下,等体积的pH=3的酸溶液和pH=11的碱溶液混合,混合后溶液的pH=7 |
| C、常温下,体积相等、pH相同的盐酸和硫酸溶液,两溶液溶质的物质的量浓度相等 |
| D、常温下,pH=3的甲酸溶液的c(H+)与pH=11的氨水溶液的c(OH-)相等 |
X、Y为短周期元素,X原子中K、L、M各电子层的电子数之比为1:4:1,Y原子比X原子少3个电子,下列叙述正确的是( )
| A、X、Y形成化合物表示为X2Y |
| B、X、Y形成的化合物中所含离子都是10电子微粒 |
| C、Y位于周期表中第ⅦA族,其最高正化合价为+7 |
| D、X原子半径小于Y的原子半径 |
下列装置或操作能达到实验目的是( )
A、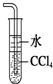 吸收NH3 |
B、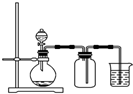 用铜片和稀硝酸制NO |
C、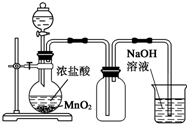 实验室制Cl2和尾气处理吸收 |
D、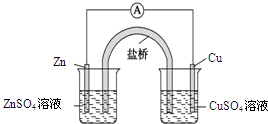 构成铜锌原电池(盐桥的作用:可使两烧杯的溶液联通) |
造成目前环境污染的因素大体上可分为物理的、化学的与生物的三个方面,它们是造成环境质量下降的主要原因,其中化学物质约占( )
| A、30~40% |
| B、50~60% |
| C、70~80% |
| D、80~90% |
下列说法正确的是( )
| A、毛巾、口罩等个人用品要经常用开水蒸煮,被褥要放在太阳光下直射,其目的都是使病毒蛋白质变性 |
| B、用浓Na2SO4、CuSO4溶液或浓硝酸溶液使蛋清液发生盐析,进而分离、提纯蛋白质 |
| C、蛋白酶是蛋白质,它不仅可以催化蛋白质的水解反应,还可以催化淀粉的水解反应 |
| D、甘氨酸(H2N-CH2-COOH)既有酸性,又有碱性,是最简单的氨基酸 |