题目内容
X、Y为短周期元素,X原子中K、L、M各电子层的电子数之比为1:4:1,Y原子比X原子少3个电子,下列叙述正确的是( )
| A、X、Y形成化合物表示为X2Y |
| B、X、Y形成的化合物中所含离子都是10电子微粒 |
| C、Y位于周期表中第ⅦA族,其最高正化合价为+7 |
| D、X原子半径小于Y的原子半径 |
考点:原子结构与元素周期律的关系
专题:元素周期律与元素周期表专题
分析:X、Y为短周期元素,X原子中K、L、M各电子层的电子数之比为1:4:1,则X核外各层电子数分别是2、8、2,为Mg元素,Y原子比X原子少3个电子,则Y为F元素,再结合题目分析解答.
解答:
解:X、Y为短周期元素,X原子中K、L、M各电子层的电子数之比为1:4:1,则X核外各层电子数分别是2、8、2,为Mg元素,Y原子比X原子少3个电子,则Y为F元素,
A.X和Y形成的化合物中,X显+2价、Y显-1价,所以其化合物的化学式为XY2,故A错误;
B.X、Y形成化合物时,X中最外层两个电子给予两个Y原子,所以X、Y形成的化合物中所含离子都是10电子微粒,故B正确;
C.Y位于周期表中第ⅦA族,非金属性最强,没有正化合价,故C错误;
D.电子层数越多其原子半径越大,所以X原子半径大于Y,故D错误;
故选B.
A.X和Y形成的化合物中,X显+2价、Y显-1价,所以其化合物的化学式为XY2,故A错误;
B.X、Y形成化合物时,X中最外层两个电子给予两个Y原子,所以X、Y形成的化合物中所含离子都是10电子微粒,故B正确;
C.Y位于周期表中第ⅦA族,非金属性最强,没有正化合价,故C错误;
D.电子层数越多其原子半径越大,所以X原子半径大于Y,故D错误;
故选B.
点评:本题考查了原子结构和元素周期律,根据原子各个电子层上电子确定元素,再结合物质结构、元素周期律分析解答,易错选项是C,主族元素最外层电子数与其最高正化合价数相等,但O、F元素除外,为易错点.

练习册系列答案
相关题目
阿伏加德罗常数用NA表示,下列说法中错误的选项是( )
| A、1mol O2所含的原子数目为NA |
| B、0.5mol H2O的质量为9g |
| C、16g CH4分子含有的电子数目为NA |
| D、标准状况下,11.2L氢气含有分子的物质的量是0.5mol |
对于放热反应:H2+Cl2
2HCl,下列说法错误的是( )
| ||
| A、反应物的总能量大于生成物的总能量 |
| B、该反应遵循“能量守恒定律” |
| C、该反应中,化学能只转变成热能 |
| D、断开1mol H-H键和1mol Cl-Cl键所吸收的总能量小于形成2mol H-Cl键所放出的能量 |
下列实验对应的结论正确的是( )
A、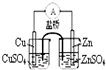 如图能组成Zn、Cu原电池 |
B、 如图能证明非金属性C>Si |
C、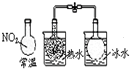 如图说明反应2NO2?N2O4,△H>0 |
D、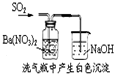 如图白色沉淀为BaSO3 |
化学腐蚀与电化学腐蚀的相同点是( )
| A、金属与氧化剂直接反应 |
| B、金属原子失电子被氧化的过程 |
| C、无电流 |
| D、有电流 |
下列符号表示的微粒,不属于官能团的是( )
| A、-OH |
| B、-COOH |
| C、-NO2 |
| D、Cl- |
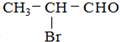 ,请回答下列问题.
,请回答下列问题.