题目内容
【题目】在某温度时将 ![]() 氨水滴入
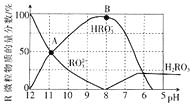
氨水滴入 ![]() 盐酸中,溶液 pH和温度随加入氨水体积变化曲线如图所示。下列有关说法正确的是
盐酸中,溶液 pH和温度随加入氨水体积变化曲线如图所示。下列有关说法正确的是

A.![]()
B.水的电离程度:![]()
C.c点:![]()
D.d点:![]()
【答案】D
【解析】
A.如果a=1,当体积为10ml时两者恰好完全反应生成氯化铵,是强酸弱碱盐水解呈酸性,所以a>1,故A错误;
B.b点溶液温度最高,说明此时两溶液恰好反应生成氯化铵,NH4+水解促进了水的电离,c点溶液呈中性,则溶质为NH4Cl和NH3H2O,NH3H2O抑制了NH4+的水解,则b点溶液中水的电离程度大于c点溶液中水的电离程度,故B错误;
C.c点溶液呈中性,所以c(H+)=c(OH-),由电荷守恒分析c(NH4+)+c(H+)=c(Cl-)+c(OH-),所以c(NH4+)=c(Cl-)=0.05mol/L,故C错误;
D.d点溶液呈碱性,氨水过量,溶液中为NH4Cl和氨水,溶液中存在电荷守恒:c(NH4+)+c(H+)=c(OH-)+c(Cl-),由于c(H+)<c(OH-),所以c(Cl-)<c(NH4+),故D正确;
故答案为D。

【题目】随着大气污染的日趋严重,国家拟于“十二五”期间,将二氧化硫(SO2)排放量减少8%,氮氧化物(NOx)排放量减少10%,二氧化碳(CO2)的排放量也要大幅减少。
(1)在恒温,容积为1L恒容容器中,硫可以发生如下转化,其反应过程和能量关系如图1所示(已知:2SO2(g)+O2(g)![]() 2SO3(g) ΔH=-196.6kJmol-1),请回答下列问题:
2SO3(g) ΔH=-196.6kJmol-1),请回答下列问题:
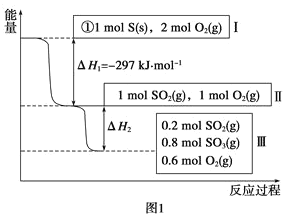
写出能表示硫的燃烧热的热化学方程式:___。
②ΔH2=___kJmol-1。
③在相同条件下,充入1molSO3和0.5mol的O2,则达到平衡时SO3的转化率为___;此时该反应___(填“放出”或“吸收”)___kJ的能量。
(2)中国政府承诺,到2020年,单位GDP二氧化碳排放比2005年下降40%~50%。
①CO2可转化成有机物实现碳循环。在体积为1L的密闭容器中,充入1molCO2和3molH2,一定条件下反应:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) ΔH=-49.0kJmol-1,测得CO2和CH3OH(g)浓度随时间变化如图2所示。从3min到9min,v(H2)=___molL-1min-1。
CH3OH(g)+H2O(g) ΔH=-49.0kJmol-1,测得CO2和CH3OH(g)浓度随时间变化如图2所示。从3min到9min,v(H2)=___molL-1min-1。

②能说明上述反应达到平衡状态的是___(填编号)。
A.反应中CO2与CH3OH的物质的量浓度之比为1:1
B.混合气体的密度不随时间的变化而变化
C.单位时间内消耗3molH2,同时生成1molH2O
D.CO2的体积分数在混合气体中保持不变
③为加快化学反应速率且使体系中气体的物质的量减少,其他条件不变时,可采取的措施有___(填编号)。
A.升高温度 B.缩小容器体积 C.再充入水蒸气 D.使用合适的催化剂
(3)工业上,CH3OH也可由CO和H2合成。参考下表中合成反应CO(g)+2H2(g)![]() CH3OH(g)的平衡常数。下列说法正确的是___。
CH3OH(g)的平衡常数。下列说法正确的是___。
温度/℃ | 0 | 100 | 200 | 300 | 400 |
平衡常数 | 667 | 13 | 1.9×10-2 | 2.4×10-4 | 1×10-5 |
A.该反应正反是放热反应
B.该反应在低温下不能自发进行,高温下可自发进行,说明该反应ΔS<0
C.在T℃时,1L密闭容器中,投入0.1molCO和0.2molH2,达到平衡时,CO转化率为50%,则此时的平衡常数为100
D.工业上采用稍高的压强(5MPa)和250℃,是因为此条件下,原料气转化率最高