题目内容
【题目】下列有关2个电化学装置的叙述正确的是

A. 装置①中,电子移动的路径是:Zn→Cu→CuSO4溶液→KCl盐桥→ZnSO4溶液
B. 在不改变总反应的前提下,装置①可用Na2SO4替换ZnSO4,用石墨替换Cu棒
C. 装置②中采用石墨电极,通电后,由于OH-向阳极迁移,导致阳极附近pH升高
D. 若装置②用于铁棒镀铜,则N极为铁棒
【答案】B
【解析】
A.电子的移动方向为:Zn→Cu→CuSO4溶液→KCl盐桥→ZnSO4溶液,电子只经过外电路,缺少内电路离子的定向移动,溶液中由离子的定向移动形成闭合回路,故A错误;
B.Na2SO4替换ZnSO4,负极仍是锌放电,原电池中的铜本身未参与电极反应,所以可用能导电的石墨替换Cu棒,故B正确;
C.阳极是氯离子放电,生成酸性气体氯气,氯离子放电结束后是水电离出的氢氧根离子放电,导致阳极附近pH降低,故C错误;
D.若装置②用于铁棒镀铜,则N极为铜棒,故D错误。
故选B。

 长江作业本同步练习册系列答案
长江作业本同步练习册系列答案【题目】已知有反应:2A(g)+B(g)![]() 3C(g) △H<0,在恒容的密闭容器中,通入A和B气体,反应达到平衡后,若仅改变图中x的值,则y随x变化趋势合理的是
3C(g) △H<0,在恒容的密闭容器中,通入A和B气体,反应达到平衡后,若仅改变图中x的值,则y随x变化趋势合理的是
选项 | x | y |
|
A | 温度 | 容器内混合气体的密度 | |
B | A的物质的量 | B的转化率 | |
C | 催化剂的质量 | C的体积分数 | |
D | 充入稀有气体 | 逆反应速率 |
A. A B. B C. C D. D
【题目】碱式硫酸铁[Fe(OH)SO4]是一种用于污水处理的新型高效絮凝剂,在医药上也可用于治疗消化性溃疡出血。工业上利用废铁屑(含少量氧化铝、氧化铁等)生产碱式硫酸铁的工艺流程如下:
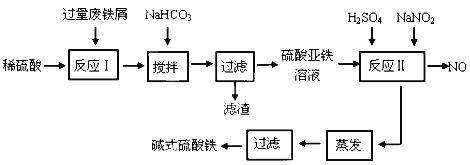
已知:部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
沉淀物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 |
开始沉淀 | 2.3 | 7.5 | 3.4 |
完全沉淀 | 3.2 | 9.7 | 4.4 |
请回答下列问题:
(1)加入少量NaHCO3的目的是调节pH范围在__________________________内,使溶液中的___________________沉淀(写离子符号),该反应的离子方程式为_________________________________ 。
(2)反应Ⅱ中的离子方程式为________________________________________________ 。
(3)在实际生产中,反应Ⅱ常同时通入O2以减少NaNO2的用量,若参与反应的O2有11.2 L(标准状况),则相当于节约NaNO2的物质的量为_____________________。
(4)碱式硫酸铁溶于水后产生的Fe(OH)2+离子,Fe(OH)2+可部分水解生成Fe2(OH)42+ 聚合离子,该水解反应的离子方程式为___________________________________。
(5)在医药上常用硫酸亚铁与硫酸、硝酸的混合液反应制备碱式硫酸铁。根据我国质量标准,产品中不得含有Fe2+及NO3-。为检验所得产品中是否含有Fe2+,应使用的试剂为___________________。
A.氯水 B.KSCN溶液 C.NaOH溶液 D.酸性KMnO4溶液