题目内容
10.有一透明溶液已知其中可能含有Mg2+、Cu2+、Fe2+、Al3+、NH4+、K+、Cl-、HCO3-、SO42-.当加入一种淡黄色粉末状固体物质时,有刺激性气味的混和气体放出,同时生成白色沉淀.当加入0.4mol淡黄色粉末时,共收集到0.4mol混和气体,且此时生成的沉淀最多.此后继续加入淡黄色粉末时,沉淀量逐渐减少,至加入0.45mol粉末后,沉淀量由0.25mol减少至0.15mol,再加入粉末后,沉淀就不再减少.由此实验现象及数据判断:(1)淡黄色粉末的名称为过氧化钠;
(2)溶液中肯定有Mg2+、Al3+、NH4+离子,肯定没有Cu2+、Fe2+、HCO3-离子,可能有K+、Cl-、SO42-离子;
(3)写出下列反应方程式
①淡黄粉末与水反应2Na2O2+2H2O=4NaOH+O2↑;
②产生刺激性气味气体的离子方程式OH-+NH4+=NH3↑+H2O;
③加入淡黄色粉末的物质的量由0.4mol至0.45mol时,沉淀部分消失,反应的离子方程式为Al(OH)3+OH-=AlO2-+2H2O;
(4)溶液中阳离子的物质量之比为(H+及没有确定的离子除外)n(Mg2+):n(Al3+):n(NH4+)=3:2:4.
分析 有一透明溶液已知其中可能含有Mg2+、Cu2+、Fe2+、Al3+、NH4+、K+、Cl-、HCO3-、SO42-.当加入一种淡黄色粉末状固体物质时,有刺激性气味的混和气体放出,同时生成白色沉淀,说明溶液中一定不含有Cu2+、Fe2+,推断淡黄色固体粉末为过氧化钠,与水反应生成氢氧化钠和氧气,刺激性气味的混和气体为NH3和O2,说明含有NH4+,当加入0.4mol淡黄色粉末时,共收集到0.4mol混和气体,2Na2O2+2H2O=4NaOH+O2↑,OH-+NH4+=NH3•H2O,生成氧气为0.2mol,生成氨气为0.2mol,所以生成氢氧化钠和铵根反应的为0.2mol,生成沉淀反应的氢氧化钠物质的量为0.6mol,且此时生成的沉淀最多.此后继续加入淡黄色粉末时,沉淀量逐渐减少,至加入0.45mol粉末后,沉淀量由0.25mol减少至0.15mol,证明一定含有Al3+,说明溶液中一定不含有HCO3-,且Al3+物质的量为0.1mol,生成1molAl(OH)3需要3molNaOH,沉淀量由0.25mol减少至0.15mol,剩余的氢氧化钠为0.3mol,生成沉淀为0.15mol,说明沉淀为二价金属离子形成的沉淀为Mg(OH)2,溶解1molAl(OH)3,Al(OH)3+OH-=AlO2-+2H2O,需要1molNaOH,再加入0.05mol过氧化钠反应生成1mol氢氧化钠,再加入粉末后,沉淀就不再减少.,依据分析判断元溶液中一定含有Mg2+、Al3+、NH4+、一定不含有Cu2+、Fe2+、HCO3-,可能含有K+、Cl-、SO42-中的一种或几种,据此分析回答问题.
解答 解:有一透明溶液已知其中可能含有Mg2+、Cu2+、Fe2+、Al3+、NH4+、K+、Cl-、HCO3-、SO42-.当加入一种淡黄色粉末状固体物质时,有刺激性气味的混和气体放出,同时生成白色沉淀,说明溶液中一定不含有Cu2+、Fe2+,推断淡黄色固体粉末为过氧化钠,与水反应生成氢氧化钠和氧气,刺激性气味的混和气体为NH3和O2,说明含有NH4+,当加入0.4mol淡黄色粉末时,共收集到0.4mol混和气体,2Na2O2+2H2O=4NaOH+O2↑,OH-+NH4+=NH3↑+H2O,生成氧气为0.2mol,生成氨气为0.2mol,所以和铵根反应的氢氧化钠为0.2mol,生成沉淀反应的氢氧化钠物质的量为0.6mol,且此时生成的沉淀最多.此后继续加入淡黄色粉末时,沉淀量逐渐减少,至加入0.45mol粉末后,沉淀量由0.25mol减少至0.15mol,证明一定含有Al3+,说明溶液中一定不含有HCO3-,且Al3+物质的量为0.1mol,生成1molAl(OH)3需要3molNaOH,沉淀量由0.25mol减少至0.15mol,剩余的氢氧化钠为0.3mol,生成沉淀为0.15mol,说明沉淀为二价金属离子形成的沉淀为Mg(OH)2,溶解1molAl(OH)3,需要1molNaOH,再加入0.05mol过氧化钠反应生成1mol氢氧化钠,再加入粉末后,沉淀就不再减少,依据分析判断原溶液中一定含有Mg2+、Al3+、NH4+、一定不含有Cu2+、Fe2+、HCO3-,可能含有K+、Cl-、SO42-中的一种或几种,
(1)淡黄色粉末的名称为过氧化钠,
故答案为:过氧化钠;
(2)依据分析判断原溶液中一定含有Mg2+、Al3+、NH4+、一定不含有Cu2+、Fe2+、HCO3-,溶液电中性可知,可能含有K+、Cl-、SO42-中的一种或几种,
故答案为:Mg2+、Al3+、NH4+,Cu2+、Fe2+、HCO3-,K+、Cl-、SO42-;
(3)①淡黄粉末与水反应生成氢氧化钠和氧气,反应的化学方程式为:2Na2O2+2H2O=4NaOH+O2↑,故答案为:2Na2O2+2H2O=4NaOH+O2↑;
②产生刺激性气味气体的离子方程式OH-+NH4+=NH3↑+H2O,故答案为:OH-+NH4+=NH3↑+H2O;
③加入淡黄色粉末的物质的量由0.4mol至0.45mol时,沉淀部分消失是氢氧化铝溶解于氢氧化钠溶液中,反应的离子方程式为:Al(OH)3+OH-=AlO2-+2H2O,故答案为:Al(OH)3+OH-=AlO2-+2H2O;
(4)溶液中阳离子的物质量之比为n(Mg2+):n(Al3+):n(NH4+)=0.15mol:0.1mol:0.2mol=3:2:4,
故答案为:3:2:4;
点评 本题考查无机离子推断、反应的定量计算等,综合性很强,根据离子反应、离子性质的特征和定量关系计算判断含有的离子是关键,难度很大,注意开始阶段加热,会导致氨气逸出.

 备战中考寒假系列答案
备战中考寒假系列答案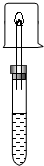 在盛有少量无水乙醇的试管中,加入一小块新切的、擦干表面煤油的金属钠,迅速用配有导管的单孔塞塞住试管口,用一小试管收集并验纯气体后,点燃,并把干燥的小烧杯罩在火焰上,片刻,迅速倒转烧杯,向烧杯中加入少量澄清石灰水.观察现象,完成下表.
在盛有少量无水乙醇的试管中,加入一小块新切的、擦干表面煤油的金属钠,迅速用配有导管的单孔塞塞住试管口,用一小试管收集并验纯气体后,点燃,并把干燥的小烧杯罩在火焰上,片刻,迅速倒转烧杯,向烧杯中加入少量澄清石灰水.观察现象,完成下表.| 乙醇与钠反应的现象 | 气体燃烧的现象 | 结论 |
| ①Na沉到试管底部 ②反应有气泡产生 | 气体燃烧时火焰呈蓝色, 小烧杯内壁有水珠, 澄清石灰水不变浑浊. | 气体产物为H2 |
| A. | 纸上层析法通常以滤纸作为惰性支持物.滤纸纤维上的羟基具有亲水性,它所吸附的水作固定相 | |
| B. | 重结晶时,溶质的溶解度越大、溶液冷却速度越慢,得到的晶体颗粒越大 | |
| C. | 制备硫酸亚铁铵晶体需要将饱和硫酸铵溶液与新制硫酸亚铁溶液混合,加热蒸发,趁热过滤 | |
| D. | 在牙膏的浸泡液中加入新制碱性Cu(OH)2,溶液变绛蓝色 |
| A. |  | B. |  | C. |  | D. |  |
| A. | CH3CH═CHCH2CH3 | B. | CH2═CHCH═CH2 | C. | CH2═CHCH3 | D. | CH3-CH═CH-CH3 |
| A. | C2H4 | B. | NaOH | C. | MgCl2 | D. | HCl |
| A. | 过氧化钠固体与水反应:2O${\;}_{2}^{2-}$+2H2O═4OH-+O2↑ | |
| B. | 实验室制Fe(OH)3胶体:Fe3++3OH-═Fe(OH)3(胶体) | |
| C. | 向澄清石灰水中通入过量CO2:OH-+CO2═HCO3- | |
| D. | 将0.1mol/L的NH4Al(SO4)2溶液与0.3mol/L的Ba(OH)2溶液等体积混合:2Al3++3SO42-+3Ba2++6OH-═2Al(OH)3↓+3BaSO4↓ |
| A. | SO2溶解于水 | B. | NO2溶解于水 | C. | CO2溶解于水 | D. | Cl2溶解于水 |
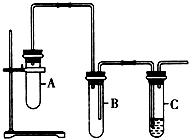 已知1,2-二氯乙烷常温下为无色液体,沸点83.5℃,密度1.23g/mL,难溶于水,易溶于醇、醚、丙酮等有机溶剂.乙醇的沸点为78.5℃.某化学课外活动小组为探究1,2-二氯乙烷的消去反应,设计了如图实验装置.请回答下列问题.
已知1,2-二氯乙烷常温下为无色液体,沸点83.5℃,密度1.23g/mL,难溶于水,易溶于醇、醚、丙酮等有机溶剂.乙醇的沸点为78.5℃.某化学课外活动小组为探究1,2-二氯乙烷的消去反应,设计了如图实验装置.请回答下列问题.