题目内容
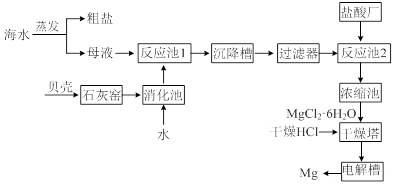
海水中提取镁的工业流程如下图所示:
回答下列问题。
⑴用贝壳而不从异地山中开凿石灰石的原因是______________________________。
⑵母液中含有MgCl2,写出反应池1的离子方程式_________________________。
⑶反应池1中,加入Ca(OH)2,使溶液的pH为11时,认为Mg2+沉淀完全[c(Mg2+)<1×10-5mol·L-1],则Mg(OH)2的溶度积约为_______________________。
⑷干燥塔中,在干燥的HCl气流中加热MgCl2·6H2O时,能得到无水MgCl2,其原因是_______________________________________________________________。
⑸电解槽中先得到的是镁的蒸气,镁蒸气可以在下列_____(填编号)气体氛围中冷却。
⑹镁可用于生产金属钛,主要步骤有:①在高温下,向金红石(主要成分TiO2)与焦炭的混合物中通入Cl2,得到TiCl4和一种可燃性气体;②在稀有气体(如氩)氛围和加热条件下,用镁与TiCl4反应可得到钛。写出上述两步反应的化学方程式。
反应①:____________________________________________________________;
反应②:____________________________________________________________。

回答下列问题。
⑴用贝壳而不从异地山中开凿石灰石的原因是______________________________。
⑵母液中含有MgCl2,写出反应池1的离子方程式_________________________。
⑶反应池1中,加入Ca(OH)2,使溶液的pH为11时,认为Mg2+沉淀完全[c(Mg2+)<1×10-5mol·L-1],则Mg(OH)2的溶度积约为_______________________。
⑷干燥塔中,在干燥的HCl气流中加热MgCl2·6H2O时,能得到无水MgCl2,其原因是_______________________________________________________________。
⑸电解槽中先得到的是镁的蒸气,镁蒸气可以在下列_____(填编号)气体氛围中冷却。
| A.空气 | B.氧气 | C.水蒸气 | D.氢气 |
反应①:____________________________________________________________;
反应②:____________________________________________________________。
⑴充分利用当地资源,变废为宝,降低生产成本,提高经济和社会效益
⑵Mg2++2OH-=Mg(OH)2↓
⑶1×10-11
⑷营造酸性氛围抑制Mg2+的水解并及时带走水蒸气
⑸D
⑹TiO2+2C+2Cl2 TiCl4+2CO TiCl4+2Mg
TiCl4+2CO TiCl4+2Mg 2MgCl2+Ti
2MgCl2+Ti
⑵Mg2++2OH-=Mg(OH)2↓
⑶1×10-11
⑷营造酸性氛围抑制Mg2+的水解并及时带走水蒸气
⑸D
⑹TiO2+2C+2Cl2
 TiCl4+2CO TiCl4+2Mg
TiCl4+2CO TiCl4+2Mg 2MgCl2+Ti
2MgCl2+Ti⑴用贝壳而不从异地山中开凿石灰石的原因是:充分利用当地资源,变废为宝,降低生产成本,提高经济和社会效益;
(2)贝壳中的碳酸钙分解能生成氧化钙,氧化钙溶于水生成氢氧化钙,所以母液中含有MgCl2,写出反应池1的离子方程式:Mg2++2OH-=Mg(OH)2↓;
(3)Mg(OH)2的溶度积为: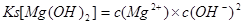 ,所以可得Mg(OH)2的溶度积约为1×10-11;
,所以可得Mg(OH)2的溶度积约为1×10-11;
(4)干燥塔中,在干燥的HCl气流中加热MgCl2·6H2O时,能得到无水MgCl2,其原因是:营造酸性氛围抑制Mg2+的水解并及时带走水蒸气;
(5)电解槽中先得到的是镁的蒸气,镁蒸气可以在氢气氛围中冷却,因其他物质均能与镁反应;
(6)TiO2+2C+2Cl2 TiCl4+2CO TiCl4+2Mg
TiCl4+2CO TiCl4+2Mg 2MgCl2+Ti
2MgCl2+Ti
(2)贝壳中的碳酸钙分解能生成氧化钙,氧化钙溶于水生成氢氧化钙,所以母液中含有MgCl2,写出反应池1的离子方程式:Mg2++2OH-=Mg(OH)2↓;
(3)Mg(OH)2的溶度积为:
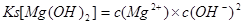 ,所以可得Mg(OH)2的溶度积约为1×10-11;
,所以可得Mg(OH)2的溶度积约为1×10-11;(4)干燥塔中,在干燥的HCl气流中加热MgCl2·6H2O时,能得到无水MgCl2,其原因是:营造酸性氛围抑制Mg2+的水解并及时带走水蒸气;
(5)电解槽中先得到的是镁的蒸气,镁蒸气可以在氢气氛围中冷却,因其他物质均能与镁反应;
(6)TiO2+2C+2Cl2
 TiCl4+2CO TiCl4+2Mg
TiCl4+2CO TiCl4+2Mg 2MgCl2+Ti
2MgCl2+Ti
练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
 4Al+3O2↑
4Al+3O2↑ 2Fe+3CO2
2Fe+3CO2 2Na+Cl2↑
2Na+Cl2↑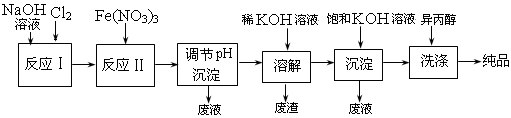
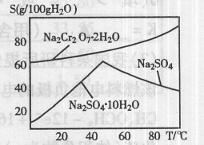
 8Na2CrO4+2Fe2O3+8CO2
8Na2CrO4+2Fe2O3+8CO2 。
。
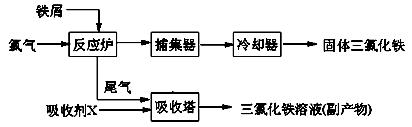
 解
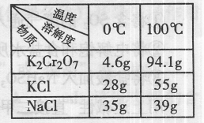
解 理剂,无水FeCl3的熔点为555K、沸点为588K。工业上制备无水FeCl3的一种工艺如下:
理剂,无水FeCl3的熔点为555K、沸点为588K。工业上制备无水FeCl3的一种工艺如下: