题目内容
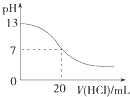
【题目】常温下,用0.02molL﹣1MOH溶液滴定100mL0.01molL﹣1HA溶液,如图为加入MOH溶液的体积与混合溶液的pH变化情况(溶液体积变化勿略不计).回答下列问题: 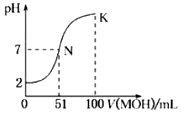
(1)由图中信息可知HA为酸(填“强”或“弱”),滴定所用的最适宜指示剂为 , 滴定时眼睛注视 .
(2)常温下一定浓度的MA稀溶液的pH=a,则a7(填“大于”、“小于”或“等于”)此时,溶液中水电离出的c(OH﹣)=mol/L.
(3)请写出K点所对应的溶液中离子浓度的由大到小的关系: .
(4)K点所对应的溶液中,c(M+)+c(MOH)2c(A﹣);(填“大于”“小于”“等于”)
(5)室温下MOH溶液加水稀释过程中,下列数值变小的是(填序号) ①c(H+) ② ![]() ③c(OH﹣) ④
③c(OH﹣) ④ ![]() .
.
【答案】
(1)强;甲基橙;锥形瓶内颜色变化
(2)<;10﹣a
(3)c(M+)>c(A﹣)>c(OH﹣)>c(H+)
(4)等于
(5)③
【解析】解:(1)根据图知,未加碱时0.01molL﹣1HA溶液的pH=2,说明溶液中c(H+)=c(HA),HA完全电离为强酸; 当混合溶液的pH=7时,n(HA)<n(MOH),说明MOH部分电离为弱碱,二者恰好完全中和时生成的MA是强酸弱碱盐,其溶液呈酸性,所以需要选取甲基橙为指示剂;滴定时眼睛要注视混合溶液颜色变化,所以眼睛要注视锥形瓶内颜色变化,所以答案是:强;甲基橙;锥形瓶内颜色变化;(2)MA是强酸弱碱盐,其阳离子水解导致该溶液呈酸性,所以a<7;水电离出的c(OH﹣)等于该溶液中c(H+)为10﹣a mol/L,所以答案是:<;10﹣a;(3)K点n(MOH)=2n(HA),溶液中的溶质为等物质的量浓度的MOH和MA,MOH电离程度大于MA水解程度导致溶液呈碱性,则c(OH﹣)>c(H+),结合电荷守恒得c(M+)>c(A﹣),MOH电离较微弱,所以溶液中离子浓度大小顺序是c(M+)>c(A﹣)>c(OH﹣)>c(H+),所以答案是:c(M+)>c(A﹣)>c(OH﹣)>c(H+);(4)K点n(MOH)=2n(HA),溶液中存在物料守恒,根据物料守恒得c(M+)+c(MOH)等于2c(A﹣),所以答案是:等于;(5)MOH溶液加水稀释促进MOH电离,但MOH电离增大程度小于溶液体积增大程度,则溶液中c(OH﹣)、c(MOH)、c(M+)都减小,①c(OH﹣)减小,离子积常数不变,则c(H+)增大,故错误;②稀释过程中c(OH﹣)减小, ![]() =
= ![]() 增大,故错误;③稀释过程中促进MOH电离,但其电离增大程度小于溶液体积增大程度,所以c(OH﹣)减小,故正确;④稀释过程中c(OH﹣)、c(M+)减小程度相同,则
增大,故错误;③稀释过程中促进MOH电离,但其电离增大程度小于溶液体积增大程度,所以c(OH﹣)减小,故正确;④稀释过程中c(OH﹣)、c(M+)减小程度相同,则 ![]() 不变,故错误;所以答案是:③.
不变,故错误;所以答案是:③.

 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案