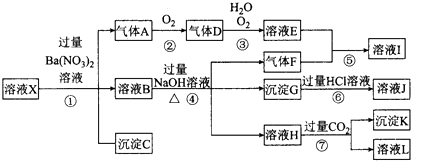
题目内容
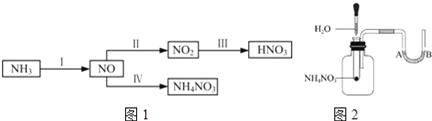
【题目】NH3经一系列反应可以得到HNO3和NH4NO3,如图1所示.
【资料卡片】
i.NH4NO3是一种白色晶体,易溶于水,微溶于乙醇.
ii.在230℃以上时,同时有弱光:2NH4NO3═2N2↑+O2↑+4H2O
iii.在400℃以上时,剧烈分解发生爆炸:4NH4NO3═3N2↑+2NO2+8↑H2O
(1)如图2将水滴入盛有硝酸铵的试管中,观察到的A处液面上升,B处液面下降,产生该现象的原因________.一段时间后还能观察到的现象是____________.
(2)实验室可以用氯化铵和熟石灰反应来制备氨气,该反应的化学方程式是______,能否用硝酸铵代替氯化铵,______(填“能”或“不能”),理由是______.
(3)从反应类型角度分析在I~IV的转化过程中的共同点是___________________。
【答案】 硝酸铵溶于水吸收热量,集气瓶中气体受冷,压强减小 A处液面下降,B处液面上升,水平导管中液柱向右移动 2NH4Cl+Ca(OH)2![]() CaCl2+2NH3↑+2H2O 不能 硝酸铵受热易爆炸 都是氧化还原反应
CaCl2+2NH3↑+2H2O 不能 硝酸铵受热易爆炸 都是氧化还原反应
【解析】(1)硝酸铵易溶于水,溶解时吸收热量,温度降低,压强减小,所以观察到的A处液面上升,B处液面下降;硝酸铵见光分解生成氮气和二氧化氮,集气瓶中压强增大,因此一段时间后还能观察到的现象是A处液面下降,B处液面上升,水平导管中液柱向右移动;(2)氯化铵与氢氧化钙在加热条件下反应生成氨气、氯化钙和水,反应的化学方程式为2NH4Cl+Ca(OH)2![]() CaCl2+2NH3↑+2H2O;硝酸铵受热易爆炸,所以不能用硝酸铵代替氯化铵;(3)转化中氨气中氮元素为-3价,经过反应Ⅰ生成一氧化氮,一氧化氮中氮元素为+2价,一氧化氮与氧气反应生成二氧化氮,二氧化氮中氮元素为+4价,二氧化氮与水反应生成硝酸和一氧化氮,硝酸中氮元素为+5价,一氧化氮发生反应Ⅳ生成硝酸铵,硝酸铵中氮元素化合价为-3价和+5价,所以在I~IV的转化过程中都存在元素化合价变化,都属于氧化还原反应。
CaCl2+2NH3↑+2H2O;硝酸铵受热易爆炸,所以不能用硝酸铵代替氯化铵;(3)转化中氨气中氮元素为-3价,经过反应Ⅰ生成一氧化氮,一氧化氮中氮元素为+2价,一氧化氮与氧气反应生成二氧化氮,二氧化氮中氮元素为+4价,二氧化氮与水反应生成硝酸和一氧化氮,硝酸中氮元素为+5价,一氧化氮发生反应Ⅳ生成硝酸铵,硝酸铵中氮元素化合价为-3价和+5价,所以在I~IV的转化过程中都存在元素化合价变化,都属于氧化还原反应。

 考前必练系列答案
考前必练系列答案