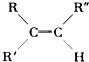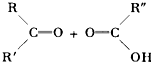��Ŀ����
����Ŀ��һ�������£������Ϊ10L���ܱ������У�1mol X��1mol Y���з�Ӧ��2X��g��+Y��g��Z��g������60s�ﵽƽ�⣬����0.3mol Z������˵����ȷ���ǣ� ��
A.������ѹǿ��������Y��ת���ʼ�С
B.�����������Ϊ5 L��Z��ƽ��Ũ�ȱ�Ϊԭ����2��
C.YŨ�ȱ仯��ʾ�ķ�Ӧ����Ϊ0.0005 mol/��Ls ��
D.�������¶ȣ�X���������������÷�Ӧ�ġ�H��0
���𰸡�C
���������⣺A���÷�ӦΪ���������С�ķ�Ӧ������ѹǿƽ�������ƶ���������Y��ת��������A���� B�������Сһ�룬��ƽ�ⲻ�ƶ���Z��Ũ��Ϊԭ����2����������ѹǿƽ�������ƶ�����Z��ƽ��Ũ�ȱ����ԭ����2������B����
C��YŨ�ȱ仯��ʾ�ķ�Ӧ����Ϊ ![]() =0.0005 mol/��Ls ������C��ȷ��
=0.0005 mol/��Ls ������C��ȷ��
D���������¶ȣ�X�������������֪�����¶ȣ�ƽ�������ƶ�����÷�Ӧ�ġ�H��0����D����
��ѡC��
��60s�ﵽƽ�⣬����0.3mol Z����
2X��g��+ | Y��g�� | Z��g�� | |
��ʼ | 1 | 1 | 0 |
ת�� | 0.6 | 0.3 | 0.3 |
ƽ�� | 0.4 | 0.7 | 0.3 |
A���÷�ӦΪ���������С�ķ�Ӧ������ѹǿƽ�������ƶ���
B�������Сһ�룬��ƽ�ⲻ�ƶ���Z��Ũ��Ϊԭ����2����������ѹǿƽ�������ƶ���
C�����v= ![]() ���㣻
���㣻
D���������¶ȣ�X�������������֪�����¶ȣ�ƽ�������ƶ���

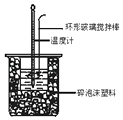
����Ŀ��ij��ѧС�����û������Ʊ�����ϩ���������������£���Ӧԭ���� 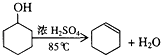 ��Ӧ���������������ʣ�
��Ӧ���������������ʣ�
�ܶȣ�g/cm3�� | �۵㣨�棩 | �е㣨�棩 | �ܽ��� | |
������ | 0.96 | 25 | 161 | ������ˮ |
����ϩ | 0.81 | ��103 | 83 | ������ˮ |
��1��ʵ������п��ܷ������л�����Ӧ�ķ���ʽΪ ��
��2�������������ϣ�װ�ã�A��B��C��������������ɱ����Ʊ�ʵ�飮 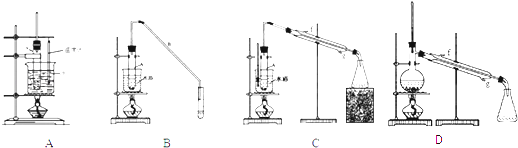
��3���Ʊ��ֲ�Ʒ ��5mL�����Թ�A�У��ټ���10m �� ҡ�Ⱥ�������Ƭ��������������Ӧ��ȫ��
��4���ֲ�Ʒ�ᴿ �ٻ���ϩ�ֲ�Ʒ�к��л������������������ʵȣ��ֲ�Ʒ�����ξ���ˮϴ����̼������Һϴ���Լ��ڶ���ˮϴ���ڴ˹����м���̼������Һ��Ŀ��������Һʱ������ϩӦ�ӷ�Һ©��������ϡ����¡�����ȡ����
����ˮϴ��Ļ���ϩ�м�����������ˮ�Ȼ��ƣ��ٽ���������ͼD��ʾװ�õ������������ƣ��У����������ռ���Ʒʱ���¶ȼ���ʾ���¶�ӦΪ ��