题目内容
【题目】下列各表述与示意图一致的是( )
A.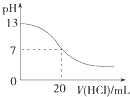 图表示25℃时,用0.1 molL﹣1盐酸滴定20 mL 0.1 molL﹣1 NaOH溶液,溶液的pH随加入酸体积的变化
图表示25℃时,用0.1 molL﹣1盐酸滴定20 mL 0.1 molL﹣1 NaOH溶液,溶液的pH随加入酸体积的变化
B.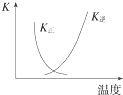 图中曲线表示反应2SO2(g)+O2(g)2SO3(g)△H<0正、逆反应的平衡常数K随温度的变化
图中曲线表示反应2SO2(g)+O2(g)2SO3(g)△H<0正、逆反应的平衡常数K随温度的变化
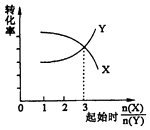
C.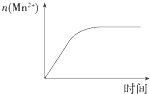 图表示10 mL 0.01 molL﹣1 KMnO4酸性溶液与过量的0.1 molL﹣1 H2C2O4溶液混合时,n(Mn2+)随时间的变化
图表示10 mL 0.01 molL﹣1 KMnO4酸性溶液与过量的0.1 molL﹣1 H2C2O4溶液混合时,n(Mn2+)随时间的变化
D.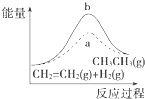 图中a、b曲线分别表示反应CH2═CH2(g)+H2(g)﹣→CH3CH3(g)△H<0使用和未使用催化剂时,反应过程中的能量变化
图中a、b曲线分别表示反应CH2═CH2(g)+H2(g)﹣→CH3CH3(g)△H<0使用和未使用催化剂时,反应过程中的能量变化
【答案】B
【解析】解:A.用0.1 molL﹣1盐酸滴定20 mL 0.1 molL﹣1NaOH溶液的pH随加入盐酸体积的变化,pH会突变,故A错误; B.2SO2(g)+O2(g)2SO3(g)△H<0,升高温度平衡向吸热方向移动,即向逆方向移动,则逆方向是平衡常数增大,正方向的平衡常数减小,图象符合,故B正确;
C.反应中生成的Mn2+对该反应有催化作用,反应过程中溶液中锰离子浓度逐渐增大,所以反应速率先慢后快,图象不符合,故C错误;
D.CH2═CH2(g)+H2(g)﹣→CH3CH3(g)△H<0,属于放热反应,放热反应中反应物的总能量大于生成物的总能量,图象不符合,故D错误.
故选B.
A.酸碱完全中和的时候pH会突变;
B.升高温度平衡向吸热方向移动;
C.反应中生成的Mn2+对该反应有催化作用;
D.放热反应中反应物的总能量大于生成物的总能量.

 暑假作业暑假快乐练西安出版社系列答案
暑假作业暑假快乐练西安出版社系列答案【题目】硫代硫酸钠溶液与稀硫酸反应的化学方程式为:Na2S2O3+H2SO4═Na2SO4+SO2↑+S↓+H2O,下列各组实验中最先出现浑浊的是( )
实验 | 反应温度/℃ | Na2S2O3溶液 | 稀H2S4 | H2O | ||
V/mL | c(molL﹣1) | V/mL | c(molL﹣1) | V/mL | ||
A | 25 | 5 | 0.1 | 10 | 0.1 | 5 |
B | 25 | 5 | 0.2 | 5 | 0.2 | 10 |
C | 35 | 5 | 0.1 | 10 | 0.1 | 5 |
D | 35 | 5 | 0.2 | 5 | 0.2 | 10 |
A.A
B.B
C.C
D.D